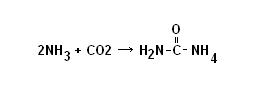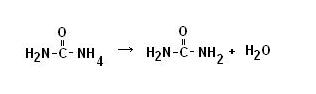I FERTILIZZANTI
Per fertilizzanti si intende qualsiasi materiale organico ed inorganico, naturale o sintetico che per il suo contenuto in elementi nutritivi o per le sue caratteristiche chimico-fisico-biologiche contribuisce al nutrimento delle specie vegetali e/o al miglioramento della fertilità del terreno.
Il termine fertilizzante è perciò un termine generale nel quale possono essere incluse sostanze con finalità applicative diverse quali:
· ammendanti
· condizionatori
· correttivi
· concimi
Le definizioni delle varie voci sopra riportate fanno testo alla Legge 748/84 G.U 6/11/84
Ammendanti e correttivi
Per ammendante e correttivo si intende qualsiasi sostanza capace di modificare e migliorare le proprietà e le caratteristiche chimico-biologico-meccaniche di un terreno.
Il termine ammendante è riservato a tutti quei materiali idonei a migliorare le proprietà fisico-meccaniche (porosità, permeabilità, tessitura e struttura), mentre il termine correttivo è destinato alle sostanze che modificano le proprietà chimico-fisiche (in particolare il pH).
Gli ammendanti sono efficaci in grandi quantità, sono da considerarsi ammendanti il letame, matrici organiche e operazioni quali il sovescio (interramento di materia vegetale fresca).
Tra i correttivi troviamo:
Per la correzione di terreni acidi: carbonato di calcio, carbonato di magnesio, dolomite, calci vive o spente, sottoprodotti calcarei, residui degli zuccherifici.
I calcari per essere efficaci devono trasformarsi in bicarbonati solubili e ciò è più facile per piccole granulometrie.
L’aggiunta di calcare anche in eccesso in genere non da problemi, mentre l’aggiunta di di ossido di calce (calce viva) può provocare una eccessiva alcalinizzazione.
Per la correzione di terreni alcalini si utilizza in genere CaSO4.7H2O (gesso) facendo seguire il trattamento con molte irrigazioni.
Anche il solfato ferroso è un acidificante (da idrolisi acida) così come lo zolfo e il solfuro ferroso che si ossidano per azione dei microorganismi liberando acido solforico.
Condizionatori
Sono flocculanti dei colloidi argillosi che migliorano lo stato di aggregazione dei costituenti primari del suolo e di conseguenza la loro stabilità.
Queste sostanze migliorano gli equilibri ionici tra la fase liquida e quella solida favorendo la nutrizione delle piante.
Il problema di queste sostanze è legato al loro costo che in genere è elevato.
Tra queste sostanze troviamo:
Alginati, poliacrilonitrile, silicato di sodio, sodio carbossimetil cellulosa, polisaccaridi di orifine batterica o polimeri di sintesi (ad esempio polimeri etilenici con molti gruppi funzionali).
Si tratta per lo più di macromolecole che agiscono o inglobando i colloidi oppure favorendone la coesione attraverso la presenza delle molte cariche presenti nella loro struttura.
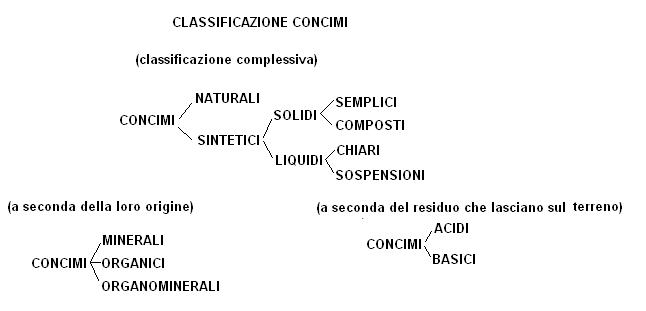
Concimi
Come concime intendiamo un materiale che contiene almeno uno degli elementi principali in quantità conosciuta e in forma assimilabile e disponibile per le piante.
Per TITOLO di un concime intendiamo la percentuale peso/peso di uno o più elementi principali espressi sul tal quale.
Per i concimi liquidi si può esprimere la percentuale peso/volume a 20°C.
Le % sono espresse come:
· %N (azoto elementare)
· %P2O5 (anidride fosforica)
· %K2O (ossido di potassio)
Ciò non significa che il concime contenga solo anidride fosforica o ossido di potassio, ma che si comporta come se contenesse una percentuale espressa su quel particolare composto.
I concimi possono distinguersi sotto vari criteri, ad esempio
Un concime viene definito:
Semplice: se contiene un solo elemento principale.
Composto: se contiene più di un elemento principale (con due binario, con tre ternario)
I concimi composti vengono individuati da tre numeri che indicano rispettivamente il titolo di N, P2O5 e K2O.
Oggi i più comuni fertilizzanti hanno come somma dei titoli valori di 40-50 unità.
I rapporti tra i diversi elementi sono molto vari ei fini di soddisfare le diverse esigenze colturali.
In genere i concimi composti contengono sempre sostanze antiimpaccanti (farina fossile, caolino o altro).
Nella loro formulazione bisogna stare attenti che non si sviluppino reazioni tra i vari composti che possono dare diversi problemi, ad esempio l’urea con il fosfoto monocalcico produce acqua che impacca il miscuglio.
I concimi organici (sinonimo di concimi naturali) non sono prontamente attivi (devono essere fatti maturare) ma hanno il pregio di reintegrare i cicli delle sostanze naturali.
Sono di diverso tipo ad esempio possono essere:
· scarti di macelleria (penne, piume, corna) naturali o torrefatti (cornunghia)
· escrementi di uccelli (pollina)
· residui di lavorazioni di pelli e lana (cuoio torrefatto o altro)
I concimi organominerali si ottengono dalla miscelazione di concimi minerali (sintetici) con concimi organici. La matrice organica deve essere minimo del 5% con un contenuto minimo di 1% di N organico e 7,5% di carbonio organico.
Nei concimi si aggiungono in genere anche microelementi sottoforma di:
· tetraborato sodico
· sodio molibdato
· solfati degli altri microelementi
· ossidi e carbonati di microelementi metallici
· Frits (fritte) fusioni di microelementi con silice
· Chelati (complessi dei microelementi con sostanze quali l’EDTA)
Si possono combinare fertilizzanti granulari e liquidi stando attenti però ad interferenze, ad esempio fosfati possono far precipitare ferro.
Nonostante il ruolo ancora oggi giocato da concimi organici, gli sviluppi dell’agricoltura negli ultimi cento anni è sicuramente legata all’introduzione dei concimi sintetici.
L’industria dei concimi è nata in Inghilterra nel 1842 con la produzione del superfosfato, ma ha avuto un grande impulso solo con la sintesi industriale dell’ammoniaca e con lo sviluppo dell’industria petrolifera.
Nei prossimi capitoli tratteremo i principali concimi sintetici che si trovano attualmente in commercio.
I concimi azotati
I principali concimi azotati sono:
1. solfato di ammonio
2. cloruro di ammonio
3. nitrato di ammonio
4. nitrato di calcio
5. nitrato di sodio
6. urea
7. calcio cianammide
Quasi tutti questi concimi hanno come precursore l’ammoniaca, che viene sintetizzata attraverso la reazione dell’azoto gassoso con l’idrogeno in impianti che lavorano a temperature intorno a 500°C e pressioni elevatissime (circa 300 atm). Per taluni produzioni può essere utilizzata anche l’ammoniaca (relativamente impura) che si ottiene come sottoprodotto nei gas di cokeria (derivanti dagli altiforni di produzione della ghisa e dell’acciaio).
N2 + 3 H2 ->2 NH3
Dall’ammoniaca per ossidazione si può quindi ottenere l’acido nitrico che viene utilizzato per produrre i vari concimi nitrici sopra elencati.
1. solfato di ammonio (NH4)2SO4
· vantaggi: poco igroscopico, buona efficienza agronomica anche per effetto dello ione solfato che esplica azione acidificante.
· svantaggi: ha un basso titolo in azoto (21%) quindi maggiori costi di immagazzinamento e trasporto.
determinazione del titolo partendo dalla formula
Consideriamo il (NH4)2SO4
determiniamo il peso molecolare
N = 14 x2 = 28 S = 32 x 1 = 32
H = 1 x 8 = 8 0 = 16 x 4 = 64
peso molecolare = 132
peso azoto contenuto = 28
% N = (28 grammi/132 grammi) * 100 = 21%
· Processo di produzione: si fa reagire dell’ammoniaca gassosa con una soluzione di acido solforico.
2NH3(g) + H2SO4(l) -> (NH4)2SO4(s)
l’ammoniaca può essere di sintesi o derivata dai gas di cokeria, l’acido solforico spesso è un acido impuro proveniente dalla lavorazione del petrolio.
Il fatto che l’acido solforico sia impuro in genere non è un problema infatti le impurezze riducono la tendenza dei cristalli si solfato di ammonio di impaccarsi e fanno assumere delle forma più granulose e meno spigolose.
2. cloruro di ammonio NH4Cl
· vantaggi: buono per la produzione del riso (molto utilizzato in Giappone e India) in quanto nitrifica lentamente e quindi si perde in risaia meno azoto, inoltre a differenza del solfato di ammonio il cloruro di ammonio non può essere trasformato, da funghi presenti in risaia, a solfuro che esplica azione fitotossica.
· svantaggi: La scarsa velocità di nitrificazione e la presenza di ione cloruro può non essere però positiva per altri tipi di colture. Anche il titolo del 26% non è molto alto.
· Processo di produzione: può essere ottenuto direttamente dalla reazione tra ammoniaca e acido cloridrico
NH3(g) + HCl(l) -> NH4Cl(s)
o come sottoprodotto della produzione del bicarbonato di sodio
NH4HCO3 + NaCl -> NH4Cl + NaHCO3
3. nitrato di ammonio NH4NO3
Si tratta della forma di concime azotato più utilizzata nei Paesi europei e nelle zone a clima temperato
· vantaggi: alta disponibilità per le colture (maggiore dell’urea e del solfato di ammonio)
buon titolo di azoto (35%)
bassi costi di produzione
· svantaggi: igroscopico
esplosivo
sensibile al dilavamento
· Processo di produzione: si ottiene per reazione tra ammoniaca ed acido nitrico e successive fasi di essicazione
NH3(g) + HNO3(l) -> NH4NO3(s)
Il prodotto finito si conserva in sacchi ben sigillati con l’aggiunta di stabilizzanti, in particolare:
1. stabilizzatori cristallini (per ridurre igroscopia) che sono in genere miscele di solfato di ammonio e fosfato biammonico
2. stabilizzanti antiesplosivi: in genere solfato di ammonio, carbonato di ammonio e caolino (argilla) i quali riducono gli urti tenendo separati i granuli.
Ne consegue che dall’analisi chimica del nitrato di ammonio ad uso di concime si possono trovare solfati, carbonati e fosfati.
4. 5. nitrato di calcio Ca(NO3)2 nitrato di sodio NaNO3
Diminuiscono l’acidità del terreno ed hanno un titolo di azoto di circa il 15%.
Il nitrato di calcio si produce industrialmente per reazione tra carbonato di calcio e acido nitrico (ha il grave difetto di essere molto igroscopico), mentre il nitrato di sodio viene estratto da miniere (in particolare cilene).
6. urea NH2CONH2
E’ stato il primo composto organico sintetizzato con materiali inorganici.
Per essere utilizzato dalle piante deve essere sottoposto a due trasformazioni:
1. idrolisi dell’azoto ureico in azoto ammoniacale
2. nitrificazione dell’azoto ammoniacale
Si tratta di trasformazioni veloci in climi caldi, mentre risultano lente in climi freddi.
· Vantaggi elevato titolo di azoto (47%)
buona efficacia concimante in fase di semina o presemina
poco igroscopica
· Svantaggi a secco può subire una decomposizione termica a biureto (fitotossico)
tende a reagire con sali ammonici dando composti che si impaccano
· Processo di produzione: avviene in due stadi
1. reazione dell’ammoniaca con l’anidride carbonica per formare carbammato di ammonio (veloce)
2. decomposizione del carbammato in urea e acqua (lenta)
7. calciociannamide CaCN2
Si tratta di un concime in disuso per i suoi alti costi, ha un effetto alcalinizzante sul terreno e si può ottenere per reazione tra carburo di calcio e azoto in forno elettrico.
CaC2 + N2 -> CaCN2 + C
I concimi fosfatici
Le rocce fosfatiche sono il materiale di partenza per questo tipo di concimi.
Il minerale di base è la fluoroapatite 3Ca3(PO4)2.CaF2 rara allo stato puro e che in genere presenta diverse sostituzioni isomorfe (in particolare magnesio o stronzio al posto del calcio, cloro al posto del fluoro, vanadio al posto del fosforo, etc.)
In genere i minerali fosfatici usati come concimi si trovano in giacimenti di origine sedimentaria sottoforma di fosforiti.
Le fosforiti sono di composizione variabile e la loro qualità viene definita in funzione della loro % in P2O5.
Le impurità hanno una notevole importanza nella lavorazione delle fosforite in particolare il ferro e l’alluminio devono essere presenti in piccole percentuali, altrimenti si ha la formazione di fosfati insolubili.
I concimi fosfatici comprendono:
1. Superfosfato normale
2. Superfosfato triplo
3. Fosfati di ammonio
4. Scorie di Thomas
5. Termofosfati
1. superfosfato normale (impropriamente chiamato anche perfosfato minerale)
· vantaggi: basso costo di produzione e di tecnologia degli impianti
buona efficienza
· svantaggi: titolo non molto alto (circa 21%)
· processo produttivo
Si ottiene per trattamento con acido solforico della fosforiti.
Considerando come minerale principale la fluoroapatite a seconda della quantità di acido solforico impiegato di possono favorire una di queste tre reazioni.
a) 3Ca3(PO4)2.CaF2 + 10 H2SO4 -> 6H3PO4 + 10CaSO4 + 2HF
b) 3Ca3(PO4)2.CaF2 + 7 H2SO4 -> 3Ca(H2PO4)2 + 7CaSO4 + 2HF
c) 3Ca3(PO4)2.CaF2 + 4 H2SO4 -> CaHPO4 + 4CaSO4 + 2HF
La reazione che si cerca di favorire è la (b).
Il Ca(H2PO4)2 (calcio diidrogenofosfato, chiamato comunemente fosfato monocalcico) è caratterizzato da una bassa igroscopicità.
In genere però è impossibile fare avvenire una unica reazione perciò quello che si ottiene è in realtà una miscela di composti.
Per migliorare le caratteristiche finali del prodotto, dopo la reazione si lascia ulteriormente riposare (maturare) il tutto per circa un mese.
In questo modo vengono favorite queste reazioni che aumentano la % di fosfato monocalcico
(fosforite non reagita + acido fosforico prodotto) 3Ca3(PO4)2.CaF2 + 14H3PO4 -> 10Ca(H2PO4)2 + HF
(fosfato bicalcico + acido fosforico) CaHPO4 + H3PO4 -> Ca(H2PO4)2
La composizione finale del superfosfato normale è la seguente:
· Ca(H2PO4)2 ≈ 20% (fosfato monocalcico)
· H3PO4> 5% altrimenti diventa igroscopico (acido ortofosforico)
· CaHPO4 ≈ 2% (calcio idrogenofosfato chiamato comunemento fosfato bicalcico)
· fosforite non reagita ≈ 2%
· CaSO4 ≈ 50% (gesso)
· Acqua ≈ 2%
2. superfosfato triplo
Si tratta di un processo praticamente analogo a quello seguito per il superfosfato normale, solo che al posto dell’acido solforico si trattano le fosforiti con l’acido ortofosforico.
I costi sono leggermente superiori, ma si ottiene un fertilizzante con un titolo di P2O5 di circa il 45%.
La composizione del superfosfato triplo è circa la seguente:
· Ca(H2PO4)2 ≈ 70% (fosfato monocalcico)
· H3PO4> 5% altrimenti diventa igroscopico (acido ortofosforico)
· CaHPO4 ≈ 15% (calcio idrogenofosfato chiamato comunemento fosfato bicalcico)
· fosforite non reagita ≈ 5%
· CaSO4 ≈ 3% (gesso)
· Acqua ≈ 2%
3. fosfati di ammonio
Pur contenendo anche azoto, vengono usualmente trattati tra i concimi fosfatici.
La composizione dei composti puri è la seguente:
· fofato monoammonico (MAP) = NH4H2PO4 %N=12 %P2O5=62 (meno igroscopico)
· fofato biammonico (DAP) = (NH4)2HPO4 %N=21 %P2O5=54 (più alto rapporto N/P)
Sono i fertilizzanti fosfatici più utilizzati in quanto presentano titoli elevati e buone caratteristiche fisiche.
Il MAP è meno igroscopico, ma il DAP ha un più alto rapporto N/P.
Quando si vuole un rapporto N/P più alto di quello del DAP, ma un prodotto non igroscopico la combinazione ideale e MAP + solfato di ammonio.
La produzione si esegue facendo neutralizzare dell’acido ortofosforico con della ammoniaca gassosa.
A seconda dei dosaggi di ammoniaca è possibile dirottare la produzione verso il MAP o verso il DAP.
4. Scorie di Thomas
Sono il sottoprodotto della lavorazione dell’acciaio, ottenuto dalla defosforizzazione della ghisa.
Il minerale ferroso contenente troppo fosforo viene trattato allo stato fuso con del carbonato di calcio ed insufflazione di aria.
Si formano delle scorie galleggianti costituite da derivati del fosfato di calcio.
Queste scorie, raffreddate e macinate, hanno un carattere basico e sono un buon concime per terreni acidi (effetto correttivo).
5. Termofosfati
Si ottengono per trattamento al forno elettrico di fosforiti con o senza addittivi.
Hanno costi elevati e bassa attività fertilizzante quindi vengono scarsamente impiegati.
I concimi potassici
L’industria dei concimi potassici è prevalentemente una industria mineraria.
I principali minerali del potassio presenti nei giacimenti sono:
· la silvinite KCl+NaCl
· la silvite KCl
· la carnallite KCl . MgCl.6H2O
· la kainite KCl . MgSO4.3H2O
I principali concimi potassici sono:
1. il cloruro di potassio
2. il solfato di potassio
3. il nitrato di potassio
1. cloruro di potassio KCl
Si tratta del prodotto che viene in genere ottenuto direttamente per purificazione dei minerali e dal quale si ricavano poi gli altri concimi potassici
2. solfato di potassio K2SO4
Teoricamente sarebbe anch’esso estraibile dai minerali, ma il processo è complicato causa la composizione non omogenea dei minerali che non consente di utilizzare delle tecniche uniformi.
Si preferisce ottenere questo concime dal cloruro di potassio mediante dei processi industriali.
In particolare si tratta il cloruro di potassio con acido solforico o con anidride solforosa e aria.
Ci si può chiedere perché sia meglio il solfato di potassio rispetto al cloruro di potassio.
La risposta è molteplice, ci sono infatti delle colture, come il tabacco, patata e vite, che sono influenzate negativamente dai cloruri, inoltre il solfato di potassio risulta utile in terreni carenti di zolfo.
3. nitrato di potassio KNO3
E’ una fonte di azoto, oltre che di potassio.
Si ottiene per reazione del cloruro di potassio con l’acido nitrico
Concimi liquidi
Terminiamo la trattazione dei concimi con un cenno sulla formulazione di concimi allo stato liquido.
Esso possono essere:
1. concimi liquidi chiari (soluzioni vere)
2. concimi in sospensione (soluzioni eterogenee)
L’utilizzo di concimi liquidi offre alcuni importanti vantaggi, ma deve tenere conto di alcuni variabili non sempre positive.
Vantaggi
· immagazzinamento e manipolazione
· applicazione agraria
· possibile miscelazione con erbicidi
· non ci sono problemi di impacchettamento
Svantaggi
· solubilità in acqua (non tutte le sostanze lo sono)
· minore concentrazione (arrivati ad un limite di saturazione diventano insolubili)
· problemi di cristallizzazione (otturazione di ugelli e altri problemi)
· costi degli apparecchi di distribuzione
La produzione dei concimi liquidi è in genere semplice, in quanto si miscelano le soluzioni o si solubilizzano direttamente i sali solubili.
La minore concentrazione dei principi attivi è legata a problemi di solubilità, nei concimi chiari e di viscosità in quelli di sospensione.
Tra i concimi chiari troviamo
· UAN (soluzione urea-nitrato ammonico) titolo 30% N
· soluzione di polifosfato di ammonio (ottenuto per reazione tra acido fosforico e ammoniaca)
· miscele di UAN + polifosfato di ammonio + KCl
Nei concimi in sospensione di possono utilizzare materiali meno puri e meno solubili, quindi in genere meno cari.
Questi concimi richiedono però apparecchiature per la distribuzione più costose e non da tutti possedute