I colloidi
Quando sciogliamo o aggiungiamo ad un solvente un soluto siamo abituati a considerare come risultato dell’operazione una delle seguenti due casistiche:
-
il soluto si scioglie ed otteniamo una soluzione (miscuglio omogeneo)
-
il soluto non si scioglie ed otteniamo un miscuglio eterogeneo
In realtà se le particelle di soluto sono inferiori a 2μm (due micrometri) possiamo trovarci in una situazione intermedia tra le due che identifica un sistema colloidale.
Le particelle in queste condizioni sono così piccole che la soluzione seppur eterogenea può comportarsi come una soluzione omogenea, ad esempio può risultare trasparente oppure rimanere opaca nonostante una filtrazione.
Le particelle inoltre avendo delle dimensioni paragonabili a quelle della lunghezza d’onda della luce possono dare dei fenomeni ottici di opalescenza denominati effetto Tyndal, inoltre data la loro bassissima densità rimangono costantemente sospese e in balia dei moti casuali della soluzione (moti Browniani).
Mentre nelle soluzioni distinguiamo un soluto ed un solvente nelle sospensioni colloidali distinguiamo una fase disperdente (analoga al solvente) ed una fase dispersa (analoga al soluto).
Le ragioni delle piccole dimensioni di un colloide è legato al fatto che esso è costituito da un numero relativamente limitato di molecole che si uniscono le une alle altre dando origine a delle micelle.
Il n° minimo di molecole per formare una micella è detto N° di aggregazione e può variare da caso a caso.
Le molecole che originano i colloidi sono in genere costituite da una parte polare ed una parte apolare.
Poiché la fase disperdente principalmente presente in natura è l’acqua, che come sappiamo ha caratteristiche polari ecco che dette molecole cercheranno di esporre la loro parte polare verso di essa, “proteggendo” in un certo modo la parte apolare.
Supponendo che la struttura molecolare sia tipo questa:

ecco come apparirà la micella:
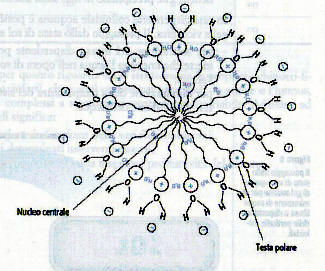
La testa polare potrà essere di carattere positivo o negativo
Particelle colloidali caricate nello stesso modo tenderanno a rimanere separate, ma l’aggiunta di determinate sostanze con caratteristiche elettriche opportune potrà determinare la formazione di macro aggregati che una volta raggiunta una certa densità precipiteranno.
A seconda che il fenomeno sia o meno reversibile avremo:
-
flocculazione (reversibile)
-
coaugulazione (irreversibile)
Una sospensione colloidale si trova generalmente in condizioni tali per cui le micelle sono libere di muoversi, ma se allontaniamo il mezzo disperdente si arriverà ad un certo punto ad una condizione in cui le micelle avranno una certa aggregazione, detta situazione si chiama GEL, mentre la situazione precedente (micelle libere) prende il nome di SOL.
Il suolo
Se analizziamo la struttura interna della terra possiamo identificare tre zone: il nucleo, il mantello e la crosta.
Fatte le debite proporzioni la crosta può essere considerata l’equivalente di una buccia che avvolge un frutto.
Il suo spessore è infatti mediamente di solo una ventina di Km rispetto ai 6000 circa del raggio terrestre.
Della crosta poi solo la parte più superficiale, che deriva in genere dal disfacimento delle rocce (LITOIDE) è utilizzabile ai fini agrari.
La fase solida del suolo è quindi costituita da due componenti:
1. componente minerale di origine litologica
2. componente organica di origine animale o vegetale
Le percentuali relative di queste due componenti variano sensibilmente da terreno a terreno; i terreni sabbiosi sono costituiti dal 99% di componente minerale, mentre in quelli agricoli quest’ultima componente scende mediamente al 97%.
La differenza non sembra molta, ma bisogna tenere presente che il peso specifico della frazione organica è di circa cinque volte inferiore rispetto alla componente minerale e quindi a parità di peso la componente organica occupa un volume di cinque volte superiore.
Inoltre, sempre mediamente la fase solida del terreno costituisce solo il 50% del volume del suolo, la restante percentuale in condizioni ottimali per lo sviluppo delle piante è costituita da un 25% in volume di aria ed un 25% in volume di acqua.
La componente minerale del suolo
La composizione elementare del suolo, nonostante le profonde alterazioni che esso può aver subito è essenzialmente costante.
Gli elementi significativamente presenti sono pochi i principali sono:
Si, Al, Na, K, Ca, Mg, Fe, O, H
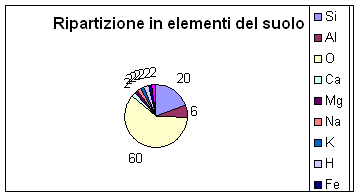
Se potessimo prendere 100 atomi di un terreno statisticamente troveremo:
60 atomi di Ossigeno
20 atomi di Silicio
6 atomi di Alluminio
e mediamente 2 di ogni altro elemento sopra indicato
Gli elementi si distribuiscono nei diversi minerali (composti inorganici omogenei con determinata struttura chimica cristallina), che a loro volta formano le rocce(aggregati di diversi minerali).
Elementi -> Minerali -> Rocce
Le rocce possono essere classificate in vari modi ad esempio se ne consideriamo l’origine distinguiamo:
1. rocce magmatiche (ignee) si originano dal magma fuso raffreddato
2. rocce sedimentarie (esogene) si originano dall’accumulo, compattazione e cementificazione delle rocce preesistenti
3. rocce metamorfiche: sono delle rocce magmatiche, sedimentarie o altre metamorfiche che all’interno della crosta terrestre subiscono trasformazioni pe effetto delle elevate pressioni e temperature
Come abbiamo detto le rocce sono formate da uno o più minerali.
La classificazione dei minerali si effettua sulla base della parte più elettronegativa che salvo per i minerali elementari (ad esempio diamante) e gli ossidi è rappresentata da un anione.
Bisogna, inoltre dire che spesso anche lo stesso ossigeno presente negli ossidi viene spesso considerato, anche se impropriamente, come se fosse un anione.
Sulla base di questa classificazione distinguiamo le seguenti 7 classi di minerali
1. elementi nativi
2. solfuri
3. ossidi
4. aloidi (floruri, cloruri)
5. carbonati
6. fosfati
7. silicati
La maggior parte dei minerali si trova allo stato cristallino, ciò significa che in essi gli atomi si dispongono in determinate strutture che si ripetono nello spazio.
Il tipo di strutture dipende:
1. dal tipo di legame che unisce gli atomi
2. dalle dimensioni degli atomi o degli ioni
In una struttura cristallina il numero di anioni ( o ossigeni) che si dispone intorno ad un atomo centrale prende il nome di N° DI COORDINAZIONE e dipende dal rapporto tra il raggio cationico ed il raggio anionico.
In pratica sono stati individuati degli intervalli del rapporto tra raggio cationico/raggio anionico che individuando uno o al massimo due valori di n° di coordinazione determinano la forma del cristallo.
Considerando in modo improprio l’ossigeno come anione ecco le principali coordinazioni che si possono ottenere con alcuni elementi (ricordiamo che in questo caso esse dipendono dal rapporto aggio cationico variabile/raggio anionico dell’ossigeno)
Coordinazione Forma Catione
4 tetraedrica S +6, P +5, Cr +6, Si +4
6 ottaedrica Mg +2, Fe + 3, Al +3
8 esaedrica Na +, Ca ++
12 icoesaedrica K+
Sebbene i minerali presenti in natura siano numerosissimi, quelli presenti in quantità significative sono pochi.
Ad esempio delle 7 classi di minerali presenti i silicati costituiscono il 90% di quelli che si trovano sulla terra.
Sono quindi i silicati quelli che incidono di più nella composizione chimica del suolo.
I silicati
Sono i minerali più rappresentati nella crosta terrestre.
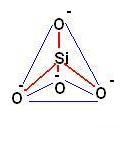
L’unità costitutiva dei silicati è il tetraedro SiO44- dove l’atomo di silicio occupa il centro ed i 4 atomi di ossigeno i vertici.
Le cariche negative dell’ossigeno vengono neutralizzate da cationi quali:
Na +, K +, Ca ++, Mg++, Fe++ o Fe+++
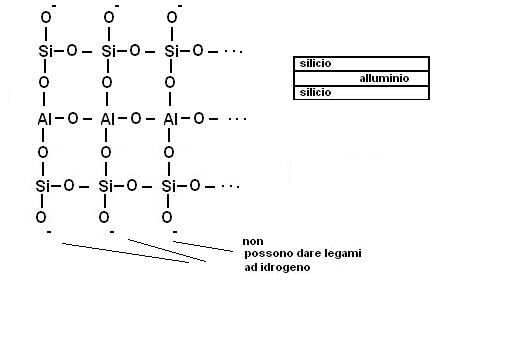
Spesso il tetraedro con atomo centrale di silicio può essere sostituito da un ottaedro con atomo centrale di Alluminio (silicoalluminati)
I tetraedri possono concatenarsi in modo diverso dando origine a 5 principali classi di silicati:
1. nesosilicati
2. sorosilicati
3. inosilicati
4. fillosilicati
5. tectosilicati
1) Nesosilicati:
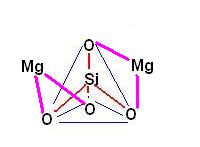
Sono rappresentati da tetraedri isolati con cariche elettriche neutralizzate prevalentemente da cationi bivalenti (Mg++, Fe++)
Tipiche rocce con questa struttura sono le olivine
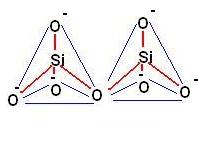
2) Sorosilicati
Possono essere costituiti da due unità tetraedriche con un vertice comune, oppure da un gruppo fino a sei unità tetraedriche che si chiude ad anello (ciclo silicati).
Ogni gruppo di tetraedri rimane indipendente e può risultare legato ad altri gruppi per intervento di cariche positive.
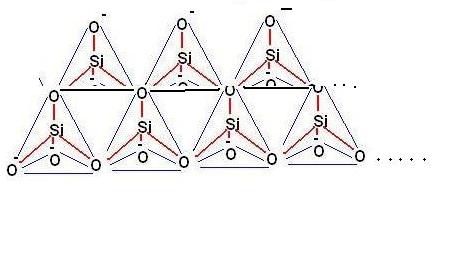
3) Inosilicati
Poiché le possibilità di unione dei gruppi SiO4—- attraverso un ossigeno comune è praticamente illimitata si possono formare catene lunghissime (polimeri) che secondo la loro struttura bi-tridimensionale danno origine agli ino, fillo e tectosilicati.
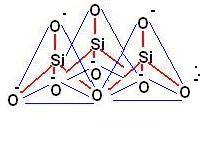
Gli inosilicati, ad esempio, sono catene lineari aperte contenenti un numero indefinito di unità tetraedriche.
Se le catene sono singole (come quelle della figura sovrastante) vengono detti PIROSSENI, mentre se sono costituite da due catene (vedi figura sotto) vengono detti ANFIBOLI
4) Fillosilicati
Nei fillosilicati i tetraedri mettono in compartecipazione tre vertici di ossigeno con tetraedri adiacenti.
Si ottiene così una specie di struttura planare a facce esaedriche sovrapposte.
Questa struttura spiega come mai i fillosilicati tendono a sfaldarsi parallelamente
5) Tectosilicato
Quando la compartecipazione degli atomi di ossigeno tra le diverse unità tetraedriche è totale otteniamo una struttura tridimensionale tipica dei tectosilicati.
Teoricamente in questo caso non ci sono cariche libere, ma se il silicio viene sostituito da altri cationi (in genere alluminio) con carica inferiore si ottengono delle cariche che vengono neutralizzate da altri cationi.
Un esempio di tectosilicati sono i feldspati (KAlSi3O8 = ortoclasio).
Le Argille
Come frazione argillosa intendiamo la parte del suolo costituita da particelle di diametro inferiore ai 2 mm (limite dei colloidi) derivante da prodotti di alterazione delle rocce e da piccole quantità di minerali primari.
A livello strutturale le argille presentano in gran parte la organizzazione dei fillosilicati, con sostituzioni più o meno ampie di atomi di silicio con atomi di carica inferiore (prevalentemente alluminio).
Tra le caratteristiche delle argille abbiamo:
· Estesa area superficiale , legata sia alla loro struttura esterna colloidale (elevato rapporto superficie/volume), sia alla loro struttura interna fatta a strati (vedi fillosilicati)
· Eccedenza di cariche negative soprattutto legate alla sostituzione del catione Si4+ con cationi a carica inferiore, ma anche legata alla dissociazione di gruppi OH di spigolo.
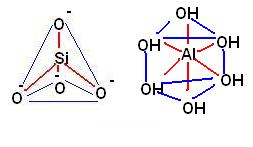
Le unità fondamentali dei reticoli cristallini delle argille sono
· il solito ione tetraedrico SiO4-4
· e il complesso ottaedrico [Al(OH)6]-3
Le argille (come i fillosilicati) hanno una organizzazione a strati sovrapposti.
La classificazione delle argille si basa per l’appunto sulla alternanza di strati di tetraedri contenenti silicio e strati ottaedri contenenti l’alluminio.
Su questa base possiamo distinguere diversi gruppi di argille:
1. Argille a due strati con rapporto silice alluminio 1:1
2. Argille a tre strati con rapporto silice alluminio 2:1
3. Argille a quattro strati tipo 2:1:1
4. Altre argille
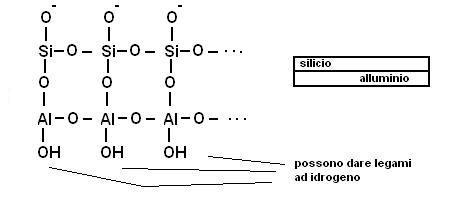
1) Argille a due strati con rapporto silice alluminio 1:1
Fanno parte di questo gruppo le caoliniti, la struttura è quella di uno strato di tetraedri di silice ed uno strato di ottaedri di alluminio con un un vertice di ossigeno in comune.
Si formano dei pacchetti a doppio strato che interagiscono tra di loro dando legami ad idrogeno.
La struttura diventa compatta, rigida, non espandibile e praticamente impermeabile.
2) Argille a tre strati con rapporto silice alluminio 2:1
Possono essere o meno espandibili a seconda del tipo di sostituzioni isomorfe e degli ioni che vanno a neutralizzare le cariche negative.
Come sostituzione isomorfa intendiamo quel fenomeno per cui gli elementi centrali Al e Si vengono sostituiti da cationi in genere aventi carica inferiore.
Il Silicio viene spesso sostituito dall’Alluminio stesso mentre,
l’Alluminio viene spesso sostituito da Fe++ e Mg++
Argille a tre strati sono : Montmorillonite, Vermiculite, Miche ed idromiche
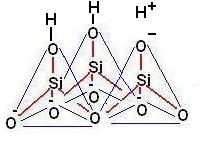
Montmorillonite: sono di questo gruppo le argille bentonitiche molto diffuse nei terreni agrari.
Nella montmorillonite le sostituzioni isomorfe interessano prevalentemente l’alluminio che viene sostituito dal Mg++
Le interazioni tra i pacchetti non presentano molti legami ad idrogeno (vedi figura sottostante).
Poichè le interazioni tra i pacchetti sono deboli l’argilla diventa espandibile e consente l’infiltrazione di acqua e cationi.
Le montmorillonite sono inoltre plastiche e si contraggono molto per essicamento.
Vermiculiti: sono simili alle precedenti solo che in questo caso anche il silicio subisce sostituzioni isomorfe (da parte dell’alluminio).
Si ha quindi un eccesso di cariche negative che vengono neutralizzate da cationi quali K+, Na+ , Mg++ e NH4+ che rendono meno dilatabile la struttura.
Miche ed idromiche, non sono espandibili, in pratica pur essendo molto simili alle vermiculiti si differenziano da esse perchè tra gli strati si collocano degli ioni K+ in maniera stabile che neutralizzano tutta la struttura e non la rendono dilatabile.
3) Argille a quattro strati tipo 2:1:1
A questo gruppo appartengono le cloriti.
In pratica sono del tutto simili alle miche solo che al posto degli ioni potassio si forma uno strato ottaedrico interstiziale di [AlMg(OH)6]+ che non rendono dilatabile la struttura.
Le cloriti sono poco fertili causa la bassa affinità con l’acqua ed il basso contenuto in minerali.
4) Altre argille
Sono quelle non catalogabili nei gruppi precedenti presentando strati misti derivanti da varie tipologie, oppure hanno scarsa organizzazione (argille amorfe).
La componente organica del suolo
Mentre la componente inorganica del suolo risulta, seppure con alcune distinzioni, piuttosto uniforme e rispecchia quella che è la composizione media della litosfera, la componente organica risulta quali-quantitativamente molto variabile ed è costituita da un complesso dinamico di sostanze diverse.
Tutti i residui di origine vegetale e animale sono essenzialmente costituiti dai seguenti elementi:
C, H, O, P, S e N.
Su questi residui, fattori biologici, microbiologici, chimici e fisici concorrono ad operare profonde trasformazioni.
Nonostante la complessità i componenti organici possono essere schematicamente suddivisi in tre gruppi:
a) residui animali e vegetali non ancora suddivisi completamente, che conservano una struttura organizzata e non sono omogeneamente incorporati nel terreno.
b) Sostanze organiche derivanti principalmente dal metabolismo microbico
c) Sostanze organiche che avendo subite profonde modificazioni risultano intimamente compenetrate nelle particelle minerali del terreno (HUMUS)
Per quanto riguarda il punto (a) non c’è molto da dire.
Per le sostanze del punto (b) dobbiamo intendere quei composti organici di origine demolitiva dei tessuti cellulari e quindi principalmente
· carboidrati (dal 30 al 50% dei tessuti vegetali)
· lipidi (di scarsa rilevanza)
· proteine (dall’1 al 15 %)
· acidi nucleici (derivati dna)
· composti fenolici
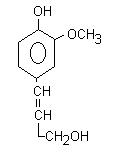
tra i composti fenolici notevole importanza l’assumono le lignine (10-30 % ) tessuti vegetali
Le lignine sono composti polimerici (strutture ad alto peso molecolare ottenute per ripetizione di una unità monomerica).
L’unità costitutiva (monomerica) delle lignine è una molecola di questo tipo:
I componenti sin qui ricordati, presenti nella frazione organica del terreno costituiscono nel loro insieme i cosiddetti “composti non umici”.
Con tale definizione possiamo infatti ricordare tutti i costituenti della frazione organica riportabili a ben definite categorie di composti chimici.
Questo composti sono destinati a subire in tempi più o meno lunghi dei processi evolutivi il cui andamento è condizionato in misura determinante dall’ambiente.
· In condizioni di perfetta aerobiosi e temperature calde l’evoluzione e di tipo prevalentemente ossidativo e porta alla formazione di CO2 e H2O; questa condizione (processo di eremacausi) è tipica delle zone desertiche del pianeta.
· In condizioni di anaerobiosi spinta e temperature basse l’evoluzione porta a processi riduttivi (carbonificazione) tipici delle regioni nordiche (Inghilterra e scandinavia)
· In condizioni intermedie si istaurano particolari fenomeni evolutivi che portano alla formazione dell’HUMUS.
Possiamo quindi dire che l’ossigeno è un fattore di notevole importanza per la fertilità del terreno e la formazione dell’Humus.
In condizioni ottimali le tipologie di Humus che si possono ottenere sono:
MOOR da materiali resinosi, tipico di terreni acidi, presenta struttura fibrosa
MULL da latifoglie, tipico di terreni alcalini struttura granulare friabile
MODER da terreni neutri con struttura intermedia.
Se le condizioni sono invece di anaerobiosi si forma TORBA, ANMOOR avente struttura fibrosa e elevato tasso di saturazione di acqua.
I composti umici
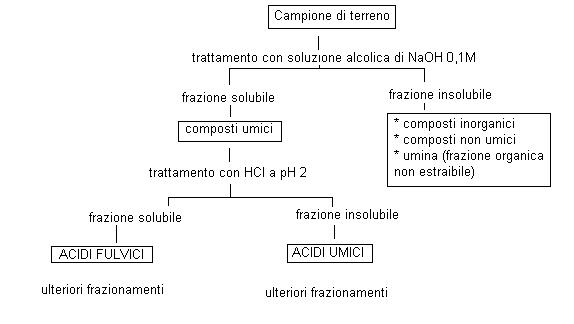
Al fine di acquisire una nomenclatura dei composti umici è opportuno iniziare il discorso introducendo quelle che sono le tecniche di laboratorio per l’estrazione di questi composti dal terreno.
Tale estrazione prevede la scelta del solvente adatto, che teoricamente dovrebbe consentire l’estrazione di queste sostanze senza apportare trasformazioni chimiche.
Il metodo internazionalmente accettato prevede le seguenti fasi
Nel terreno l’umificazione è un processo essenzialmente biologico e molto complesso.
Attualmente si ipotizza che la sintesi delle sostanze umiche avvenga in due fasi
1. decomposizione di tutti i componenti vegetali in unità semplici
2. ripolimerizzazione delle unità semplici in ambiente acido e aereato.
dalla analisi elementare dell’humus che ha un peso molecolare da 1000 a 300.000 si ottengono i seguenti risultati:
C = 52 – 62 %
N = 4 – 6 %
O = 31 – 40 %
H = 3 – 5 %
Si osservano perciò i seguenti rapporti significativi
C/N circa 10
O/H circa 9
Il primo rapporto ha un notevole interesse infatti nel corso di un processo di umificazione di un materiale con rapporto C/N molto alto, ad esempio la paglia al fine di portare questo rapporto a valori prossimi a 10 molto azoto viene sottratto dal terreno, si ha ovviamente il fenomeno contrario se si sta umificando del materiale con rapporto C/N molto basso (es sangue di bue).
Tornando alla suddivisione dei composti per estrazione in laboratorio possiamo dire che ci sono due principali classi di composti umici:
· gli ACIDI FULVICI
hanno peso molecolare minore, hanno valore del rapporto C/N più basso e sono tipici dei terreni poveri
· gli ACIDI UMICI
hanno peso molecolare elevato, sono costituiti in gran parte da composti derivanti dalle lignine, contribuiscono alla struttura del terreno ed al nutrimento delle piante
Vediamo ora quali sono gli effetti delle sostanze organiche sulla fertilità:
AZIONE DIRETTA
· Nutrizione (liberano minerali e composti organici a basso peso molecolare)
· Stimolo (pseudoormoni)
· Aumentano la capacità di scambio di elementi (specie cationi) tra suolo e vegetali)
AZIONE INDIRETTA
· Stabilizzanti della struttura del terreno (formano aggragati di micelle argillose)
· Migliorano la permeabilità nei riguardi di acqua e aria
Per valutare le caratteristiche dell’Humus si ricorre a dei parametri quali:
· quoziente di resa = sostanza organica umificata/ sostanza organica iniziale
· rapporto C/N più è basso più è grande la velocità di mineralizzazione
· natura degli acidi umici = ac. umici / ac. fulvici
e altri.