Parlando delle distinzioni tra trasformazioni chimiche e trasformazioni fisiche, abbiamo appurato che la principale differenza tra questi fenomeni è rappresentata dal tipo di interazioni che risultano coinvolte.
Mentre nelle trasformazioni fisiche sono coinvolte le interazioni tra particelle diverse (interparticellari), nelle trasformazioni chimiche sono coinvolte le interazioni interne alle particelle (intraparticellari).
Ora sappiamo che conosciamo la struttura interna della materia al termine generico di particella possiamo usare i termini più appropriati di atomi e molecole ed al posto del termine interazione utilizzeremo il termine di legame.
Prima di iniziare a parlare specificatamente dei vari tipi di legame dobbiamo porci una importante domanda:
Per quale motivo due atomi devono unirsi formando un legame e dando origine ad una molecola?
La risposta a questa domanda è legata alla struttura elettronica.
Abbiamo visto che tra gli elementi quelli che hanno la struttura elettronica più stabile sono i gas nobili.
Questi elementi hanno nell’ultimo elettronico una struttura elettronica di tipo s2p6, fatta eccezione dell’elio che avendo un solo orbitale a disposizione presenta una struttura di tipo s2.
Tutti i gas nobili, ad eccezione dell’elio, hanno per tanto otto elettroni nell’ultimo livello energetico (ottetto di elettroni), in queste condizioni l’atomo si trova in una situazione molto stabile.
Possiamo considerare la situazione di un gas nobile analoga a quella di un albergo il cui numero di ospiti è tale da riempire completamente tutte le stanze di un piano.
Un ospite in più porterebbe a dover aprire una stanza di un piano superiore, con spese energetiche non compensate dalla presenza di una sola persona, mentre un ospite in meno porterebbe solo meno guadagni in quanto le spese per la gestione del piano sono già imputate alle altre presenze di ospiti.
Se la struttura dei gas nobili è la più stabile ovviamente ne consegue che la situazione energetica di tutti gli altri elementi è “migliorabile”.
Una pallina in equilibrio su di uno scaffale si trova in una situazione instabile e ci aspettiamo che da un momento all’altro possa cadere sul pavimento.
Possiamo immaginare (anche se la situazione in realtà è più complicata) che un sistema posso evolvere da una situazione di maggiore instabilità, associabile ad un contenuto di energia maggiore (vedi pallina sullo scaffale), ad una situazione di maggiore stabilità, associabile ad un contenuto di energia minore (vedi pallina sul pavimento).
Due atomi reagiranno formando una molecola quando dalla loro unione si raggiungerà una situazione elettronica di maggiore stabilità, ossia una struttura elettronica che sarà più similare a quella dei gas nobili.
Poiché a maggiore stabilità è associata minore energia potremo pensare che dalla unione di due atomi per formare una molecola venga ceduta della energia all’ambiente.
Dati due generici atomi A e B avremo quindi:
A + B -> A-B + energia di legame
Possiamo quindi intendere l’energia di legame sia come:
a) energia associata alla formazione di una molecola per unione di due atomi
b) energia necessaria per rompere la molecola A-B ed ottenere gli atomi A e B
Ora che sappiamo i motivi che spingono due atomi ad unirsi possiamo parlare più specificatamente dei vari tipi di legami distinguendo tra queste due categorie principali:
- i legami intramolecolari (legati alle trasformazioni chimiche)
- i legami intermolecolari o interatomici (principalmente legati alle trasformazioni fisiche).
I legami intramolecolari
Sono:
- LEGAME IONICO
- LEGAME COOVALENTE (omopolare, polarizzato, dativo)
- LEGAME METALLICO
(1) IL LEGAME IONICO
Abbiamo visto che ogni elemento ha una certa tendenza a cedere o acquistare degli elettroni, questa tendenza è legata alle caratteristiche del nucleo positivo e della sua struttura elettronica.
Un elemento del settimo gruppo si trova ad avere sette elettroni nel suo ultimo livello energetico, a questo elemento manca quindi un elettrone per raggiungere il cosiddetto ottetto elettronico tipico di un gas nobile.
Un elemento del primo gruppo si trova ad avere un solo elettrone nel suo ultimo livello energetico, se questo elemento perde l’elettrone in questione va ad assumere la struttura elettronica di un gas nobile in quanto i livelli inferiori sono completi.
Possiamo quindi immaginare che gli elementi del settimo gruppo abbiano una certa tendenza ad acquistare elettroni, mentre gli elementi del primo gruppo non mostrino questa tendenza, semmai hanno la propensione a perdere degli elettroni.
La tendenza di un atomo di acquistare degli elettroni prende il nome di elettronegatività.
L’elettronegatività è una proprietà periodica che aumenta quindi lungo i periodi da destra verso sinistra, per cui è inferiore nei metalli e superiore nei non metalli.
Se consideriamo due atomi dello stesso gruppo, possiamo immaginare che il più elettronegativo sia quello in cui l’azione attrattiva del nucleo positivo sia maggiore.
Più un atomo è grande più gli elettroni dell’ultimo livello sono lontani dal nucleo quindi l’elettronegatività cala scendendo lungo i gruppi.
L’elemento più elettronegativo sarà quindi quello più a destra ed in alto nella tavola periodica ossia il fluoro (F); a questo elemento è stato assegnato arbitrariamente un valore di elettronegatività pari a quattro.
Tutti gli altri elementi hanno valori di elettronegatività inferiore a quattro, in genere detti valori sono indicati su le tavole periodiche o sui libri di testo.
Quando avviciniamo due elementi che hanno una forte differenza di elettronegatività, ad esempio il Floro con il Sodio, possiamo immaginare che l’elemento più elettronegativo cerchi di strappare l’elettrone, mentre quello meno elettronegativo abbia una notevole tendenza a cederlo.
Il Floro quindi strapperà l’elettrone al sodio diventando uno ione negativo (anione) F–.
Il sodio avendo perso l’elettrone diventerà uno ione positivo (catione) Na+.
Tra cariche negative e cariche positive si instaurano delle interazioni di tipo attrattivo di natura elettrostatica, in altre parole gli ioni F– e gli ioni Na+ risulteranno uniti da un legame che interessando degli ioni viene denominato IONICO.
Il legame ionico è quindi un legame di tipo elettrostatico che interessa delle specie ioniche e che quindi si verifica dall’unione di elementi con spiccate differenze di elettronegatività.
Il valore di differenza di elettronegatività soglia per l’instaurazione di un legame ionico è di difficile definizione, tuttavia possiamo dire che se la differenza di elettronegatività tra due elementi è minore di due un legame ionico non può formarsi.
Ne consegue che un legame ionico può essere prodotto solo dalla unione di un metallo con un non metallo (e non in tutti i casi), infatti solo in questi casi si possono raggiungere differenze con valori maggiori di due.
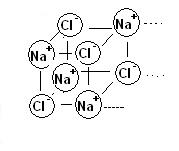
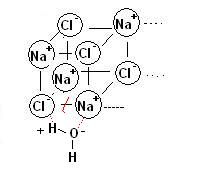
E’ da notare che nel legame ionico una ione positivo non attrae un unico ione negativo, ad esempio nel caso del NaCl possiamo immaginare una situazione di questo tipo:
Si ha quindi una struttura cubica che si ripete all’infinito.
Si ottiene un particolare tipo di solido cristallino, denominato solido ionico, che per il gran numero di interazioni interatomiche presenta un elevatissimo punto di fusione (per fondere il sale da cucina occorrono temperature superiori ai 1000°C).
Quando esprimiamo una formula di un composto ionico non indichiamo l’esatto numero di atomi che compongono la molecola bensì il rapporto in cui troviamo gli atomi nel solido ionico.
Se ad esempio disgreghiamo un cristallo di NaCl troveremo lo stesso numero di ioni Na+ e Cl–.
(2) IL LEGAME COOVALENTE
La domanda che ora ci poniamo è la seguente, come fanno due atomi con differenza di elettronegatività minore di due ad unirsi?.
Prendiamo ad esempio un atomo di idrogeno, questo possiede un solo elettrone.
In natura l’idrogeno è presente sottoforma di molecola di H2 , costituita da due atomi di idrogeno.
Due atomi di idrogeno identici, quindi aventi la stessa elettronegatività, si sono quindi uniti con un tipo di legame che sicuramente non può essere di tipo ionico visto che nessuno degli atomi interessati ha una tendenza maggiore dell’altro a strappare degli elettroni.
Per spiegare la formazione dell’ idrogeno molecolare dobbiamo quindi immaginare che si sia formato un nuovo tipo di legame.
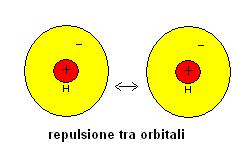
Un atomo di idrogeno è costituito da un nucleo positivo circondato da un orbitale contenente un elettrone.
L’orbitale contenente l’elettrone è paragonabile ad un guscio caricato negativamente.
Se proviamo ad avvicinare due atomi di idrogeno avremo quindi per un certo periodo l’azione di forze repulsive, dovute alla vicinanza dei due gusci negativi (come se tentassimo di avvicinare due calamite di carica uguale).
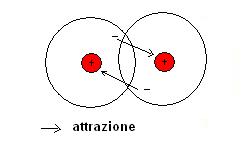
Se vinciamo questa repulsione iniziale l’elettrone di un atomo di idrogeno inizierà a risentire dell’attrazione del nucleo positivo dell’atomo dell’altro idrogeno e viceversa.
In pratica gli orbitali dei due atomi si uniranno e gli elettroni saranno messi in comune.
Ogni atomo di idrogeno sarà quindi circondato da due elettroni ed assumerà una struttura elettronica simile a quella del gas nobile elio.
Un legame coovalente è quindi un particolare tipo di legame in cui due atomi mettono in comune degli elettroni di legame.
Gli elettroni in comune sono contenuti in un orbitale di legame che appartiene ad entrambi gli atomi.
Se i due atomi interessati, come nel caso dell’idrogeno, hanno la stessa elettronegatività gli elettroni di legame si troveranno con uguali probabilità nelle vicinanze dei due atomi.
Viene definito legame coovalente puro o omopolare il particolare legame coovalente che coinvolge due atomi con uguale elettronegatività
Supponiamo ora di avere a che fare con due atomi che presentino una differenza di elettronegatività non sufficiente per formare un legame ionico, ma comunque differente da zero, ad esempio idrogeno (elettronegatività= 2,1) e cloro (elettronegatività = 3).
Anche in questo caso i due atomi formeranno un orbitale di legame mettendo in comune i due elettroni, ma essendo l’atomo di cloro più elettronegativo di quello di idrogeno sarà più probabile trovare gli elettroni vicino al cloro che non vicino all’idrogeno.
La parte della molecola più vicina al cloro avrà quindi una prevalente carica negativa (δ-), mentre la parte della molecola vicina all’idrogeno una prevalente carica positiva (δ+).
Il legame che si è formato tra idrogeno è cloro viene denominato legame coovalente polare.
Viene definito legame coovalente polare il particolare legame coovalente che coinvolge due atomi con differente elettronegatività.
E’ da sottolineare il fatto che poichè il legame coovalente polare presenta contemporaneamente le caratteristiche di un legame coovalente puro (sovrapposizione degli orbitali), che in parte quelle di un legame ionico (essendo presenti interazioni tra una parte positiva ed una negativa) a parità di altre considerazioni il legame coovalente polare è mediamente più forte di un legame coovalente omopolare.
Un particolare tipo di legame coovalente è rappresentato dal legame dativo.
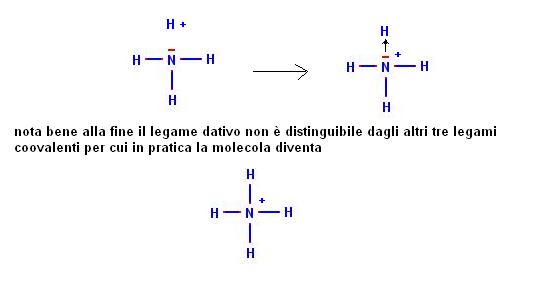
Una specie chimica che consente di comprendere bene questo tipo di legame è lo ione ammonio (NH4+).
Questo ione deriva dall’unione di una molecola di ammoniaca (NH3) con uno ione H+ secondo la seguente reazione:
NH3 + H+ -> NH4+
L’azoto è un elemento del quinto gruppo per cui si trova ad avere una struttura elettronica con cinque elettroni nell’ultimo livello energetico (cinque elettroni di valenza)
1s2, 2s2 p3
In pratica abbiamo due elettroni che completano l’orbitale “s” e tre elettroni in ognuno di tre orbitali “p”.
Una rappresentazione semplificata di questa situazione può essere fatta con questo sistema:
L’azoto ha questo punto ultimato i suoi tre elettroni spaiati formando tre legami coovalenti, come può fare ad unire un altro atomo di idrogeno presente nella molecola di NH4+?
Uno ione H+ è un atomo di idrogeno che ha perso il suo unico elettrone e che si ritrova quindi con un orbitale “s” vuoto.
L’azoto ha ancora un orbitale non interessato a nessun legame che contiene due elettroni.
Se l’orbitale vuoto dello ione H+ e l’orbitale “pieno” dell’azoto si uniscono il risultato finale è analogo a quello di un legame coovalente (due elettroni condivisi da due atomi in un orbitale di legame), quello che è cambiato è solo la provenienza dei due elettroni che derivano da una sola specie chimica.
Poichè è l’azoto a DARE i due elettroni questo tipo di legame si chiama dativo
Possiamo definire quindi il legame dativo come un particolare caso di legame coovalente in cui gli elettroni di legame provengono da una sola delle due specie chimiche interessate alla interazione.
(3) IL LEGAME METALLICO
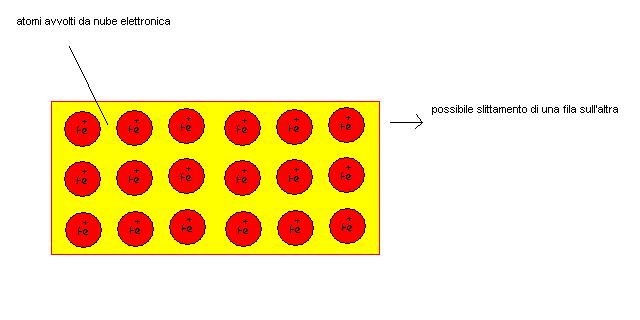
Se prendiamo un pezzo di ferro notiamo che esso presenta delle caratteristiche ben definite, intanto è solido a temperatura ambiente, poi conduce bene il calore e la corrente elettrica, infine può essere “stirato” in sottili lamine o in fili sottilissimi (duttilità e malleabilità).
Queste proprietà sono simili a molti metalli.
Ma come fanno gli atomi di ferro a stare uniti ed ad avere tutte queste proprietà non interpretabili né con un legame coovalente, né con un legame ionico.
La spiegazione di queste caratteristiche dei metalli viene spiegata con l’ipotesi di un nuovo tipo di legame denominato per l’appunto metallico.
Si immagina che i diversi nuclei del metallo possano scambiarsi liberamente gli elettroni di valenza.
In pratica è come se immaginassimo una sorta di nuvola di elettroni che accomuna tutti gli atomi di ferro.
Gli elettroni potendosi muovere liberamente tra un atomo stabilizzano la struttura e spiegano come mai i metalli siano degli ottimi conduttori.
Poichè possiamo immaginare la struttura derivante dal legame metallico come una sorta di strati di atomi sovrapposti, possiamo anche capire come questa struttura possa essere “stirata” o “filata” e quindi le caratteristiche di duttilità e malleabilità dei metalli stessi.
I legami intermolecolari
Sono:
- interazioni dipolo-dipolo (“tradizionale e legami ad idrogeno)
- interazioni di Van der Waals
(1) Interazioni dipolo-dipolo
Abbiamo visto come nella formazione di un legame coovalente polare all’interno della molecola si sviluppi un centro positivo ed un centro negativo. Questa dislocazione di cariche interne ad una molecola prende il nome di dipolo.
Maggiore è la differenza di elettronegatività tra gli atomi maggiore è l’intensità del dipolo.
Tra il centro positivo di una molecola ed il centro negativo di una molecola adiacente si possono sviluppare delle interazioni (intermolecolari) denominate per l’appunto dipolo-dipolo.
Queste interazioni sono connesse con le proprietà fisiche della molecola, abbiamo infatti già visto come maggiori siano le interazioni intermolecolari maggiore sia il punto di ebollizione e di fusione di una sostanza.
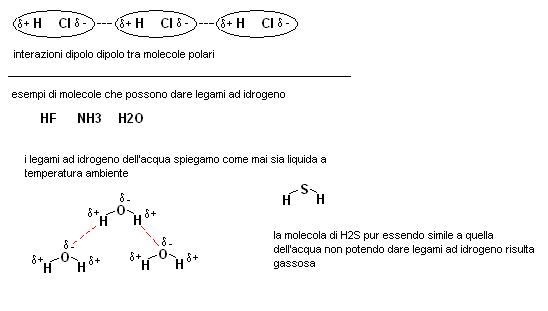
Un caso particolare di interazione dipolo-dipolo è tipico di molecole che contengono atomi di idrogeno legati ad elementi fortemente elettronegativi (O, F, N) in questo caso l’interazione intermolecolare risulta particolarmente forte e prende il nome di legame ad idrogeno.
La possibile formazione di un legame ad idrogeno tra molecole di acqua (in cui l’idrogeno è legato all’ossigeno) spiega il motivo per il quale questa sostanza sia liquida a temperatura ambiente, infatti, la molecola di acido solfidrico (H2S) che è molto simile come struttura a quella dell’acqua non potendo dare legami ad idrogeno risulta aeriforme a temperatura ambientale.
(2) Interazioni di London
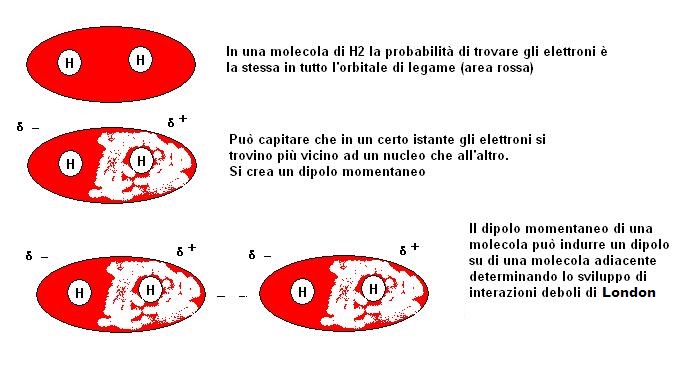
Immaginiamo ora di avere a che fare con un molecola di idrogeno (H2).
In questa molecola dato che i due atomi sono uniti da un legame coovalente puro, non si sviluppa per tanto nessun dipolo.
Le varie molecole di idrogeno non dovrebbero dare nessun tipo di interazioni intermolecolari e quindi l’idrogeno dovrebbe rimanere gassoso anche a temperature bassissime al limite dello zero assoluto.
Nella realtà anche se effettivamente l’idrogeno tende a rimanere allo stato gassoso esso diventa liquido a temperature che pur essendo molto basse, sono in realtà lontane dallo zero assoluto.
Tra le molecole di idrogeno, così come in tutte le molecole prive di dipoli (apolari) si devono manifestare delle interazioni diverse da quelle che abbiamo già visto.
Questo tipo di interazioni sono denominate interazioni di London.
Abbiamo definito l’orbitale come la regione dello spazio in cui è massima la probabilità di trovare gli elettroni.
Quando si forma un orbitale di legame gli elettroni comuni ai due atomi si localizzeranno in questa area e passeranno la maggior parte del tempo nelle vicinanze del nucleo più elettronegativo.
Se i due atomi interessati hanno la stessa elettronegatività gli elettroni non avranno una maggiore tendenza a stare vicino ad un nucleo rispetto all’altro, ma ciò non significa che saranno fermi fossilizzati in una posizione.
Nel loro muoversi potrà succedere che in un certo momento i due elettroni coinvolti in un legame coovalente omopolare si trovino casualmente nelle vicinanze di un nucleo, in quel momento si creerà un dipolo momentaneo.
La parziale polarizzazione in un certo momento di una molecola potrà indurre la polarizzazione di una molecola adiacente e con un meccanismo a catena potranno svilupparsi moltissime interazioni di bassa intensità tra molte molecole.
Queste interazioni spiegano come molecole polari possano trovarsi allo stato solido o liquido
La rappresentazione grafica delle molecole
Quando scriviamo una molecola sulla base della sua composizione atomica, ad esempio NH3, H2SO4, etc, non abbiamo nessuna informazione sul tipo di legami che in essa sono presenti.
Un aiuto per comprendere la struttura di una molecola ci viene dalle formule o rappresentazioni di Lewis.
Nelle formule di Lewis un atomo viene indicato con un numero di puntini pari agli elettroni di valenza (dell’ultimo livello energetico).
La disposizione di questi “puntini” segue la seguente regola, fino a 4 elettroni si mette un puntino su ogni lato del simbolo chimico dell’elemento, gli eventuali elettroni successivi si appaiano ai puntini già collocati (vedi riquadro NH3 relativo al legame dativo).
Esempio di rappresentazioni di Lewis di alcuni elementi:
Per costruire la formula di Lewis di un molecola non complesse basta seguire delle semplici regole:
- esaurire sempre per primi i legami coovalenti
- quando abbiamo delle molecole costituite da due elementi di cui uno è l’ossigeno (ossidi) se l’elemento diverso dell’ossigeno e presente con più atomi questi sono intervallati con atomi di ossigeno.
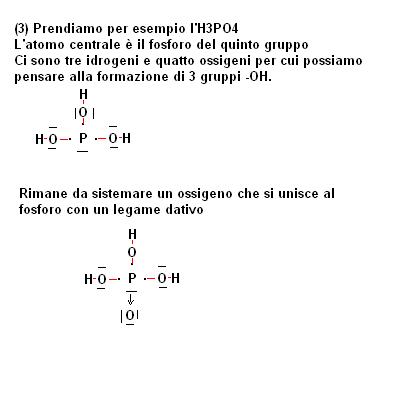
- nel caso si abbia a che fare con degli ossiacidi (molecole tipo HNO3) o con degli idrossidi (molecole tipo Ca(OH)2) si devono collocare tanti -OH sull’atomo centrale (con dei legami coovalenti ) compatibilmente con il numero di idrogeni e ossigeni presenti.
Facciamo degli esempi relativi al punto (1) (2) e (3).
La disposizione spaziale delle molecole
Sebbene le formule di Lewis ci diano una qualche informazione in merito alla struttura delle molecole in realtà risultano sempre essere delle semplificazioni.
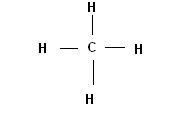
Consideriamo ad esempio la molecola del metano CH4, volendola rappresentare con la formula di Lewis avremo:
Ci troviamo ad avere quindi 4 legami coovalenti tra gli idrogeni ed il carbonio.
In ognuno di questi legami sono presenti due elettroni.
Ogni legame quindi è caratterizzato da avere carica negativa.
Poichè le cariche negative tendono a respingersi vicendevolmente i 4 legami (e quindi i 4 idrogeni) cercheranno di assumere una posizione tale da essere i più lontani possibile gli uni dagli altri.
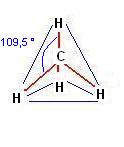
La formula di Lewis del metano in cui i legami sono a 90° gli uni dagli altri sembra rispondere bene al requisito della massima lontananza reciproca, ma cosa impedisce al metano di assumere una configurazione tridimensionale invece della disposizione planare disegnata.
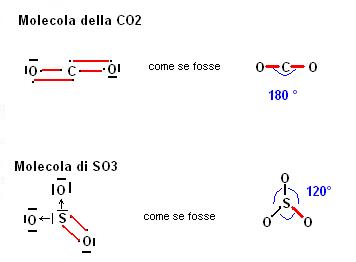
In effetti se immaginiamo che i quattro legami si dispongano nello spazio possiamo individuare una struttura in cui i legami anziché 90° possano raggiungere un angolo maggiore (109,5 °). Questa struttura è quella tetraedrica
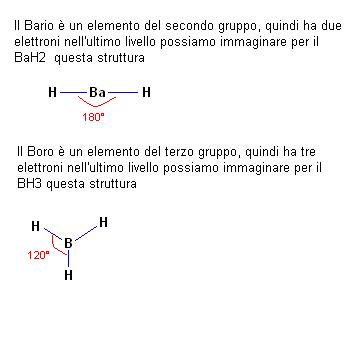
Partendo dal presupposto che gli orbitali di legame cerchino di stare il più lontano possibile possiamo valutare anche la struttura di molecole quali BaH2 e BH3
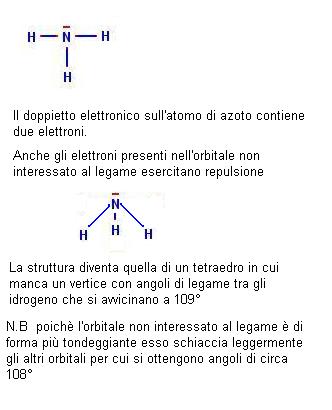
Ritorniamo ora a considerare una molecola che abbiamo già preso in considerazione ossia quella dell’ammoniaca (NH3).
Poichè attorno all’atomo di azoto abbiamo tre atomi di idrogeno potremmo pensare per questa molecola una situazione simile a quella del BH3 con angoli di 120°.
Nella realtà gli angoli tra gli atomi di idrogeno nell’ammoniaca sono di poco meno di 109° come mai?.
La risposta è piuttosto logica se consideriamo che intorno all’atomo di azoto c’è anche un orbitale non interessato al legame con gli atomi di idrogeno.
Questo orbitale non interessato al legame contiene comunque degli elettroni e quindi suscita delle interazioni repulsive.
La situazione dell’ammoniaca viene spiegata nel seguente riquadro.
Al fine di stabilire la struttura tridimensionale di una molecola non dobbiamo limitarci a guardare il numero di legami che interessano l’atomo centrale, ma il numero di orbitali che lo circondano
Un aspetto molto importante nella valutazione della disposizione spaziale di una molecola è l’eventuale formazione di doppi legami.
Si parla di doppi legami quando tra due atomi si formano due legami coovalenti
In questo caso per la valutazione della struttura tridimensionale dobbiamo considerare un doppio legame alla stregua di un legame semplice.
Il tutto diventa più evidente con alcuni esempi:
Al fine di stabilire la struttura tridimensionale di una molecola non dobbiamo limitarci a guardare il numero di legami che interessano l’atomo centrale, ma il numero di orbitali che lo circondano
Un aspetto molto importante nella valutazione della disposizione spaziale di una molecola è l’eventuale formazione di doppi legami.
Si parla di doppi legami quando tra due atomi si formano due legami coovalenti
In questo caso per la valutazione della struttura tridimensionale dobbiamo considerare un doppio legame alla stregua di un legame semplice.
Il tutto diventa più evidente con alcuni esempi:
Relazioni tra struttura e polarità
Una molecola è polare quando risente di un campo elettrico.
Se facciamo scorrere un filo di acqua nelle vicinanze di una bacchetta elettrizzata noteremo che il flusso di liquido viene deviato.
L’acqua infatti è una tipica sostanza polare.
Se ripetiamo lo stesso esperimento con altri liquidi, ad esempio con la benzina, possiamo notiamo il flusso di liquido non risente dell’azione del campo elettrico.
Per sostanze polari e apolari vale una regola generale che possiamo esprimere nei seguenti termini “simile scioglie simile”.
Una sostanza tipicamente polare non si scioglie in una sostanza apolare e viceversa.
La polarità di una molecola è legata a due fattori fondamentali.
- nella molecola devono esserci dei dipoli (quindi legami ionici o coovalenti polari)
- i dipoli non si devono annullare reciprocamente.
Il requisito (1) è abbastanza evidente, abbiamo già sottolineato come molecole quali l’idrogeno (H2) in cui ci sono legami coovalenti puri al massimo si possono sviluppare le debolissime interazioni di Van der Waals che non consentono di certo alla molecola di assumere caratteristiche polari.
Il requisito (2) invece è meno ovvio, ma ci consente di capire come mai ad esempio il metano sia apolare, mentre l’ammoniaca sia polare.
Consideriamo la formula di Lewis del metano e della ammoniaca.
In entrambe le molecole l’atomo centrale (carbonio nel metano e azoto nell’ammoniaca) sono più elettronegativi degli idrogeni.
Ci troviamo ad avere quindi 4 dipoli nel metano e 3 dipoli nell’idrogeno.
Possiamo immaginare i dipoli come dei vettori disposti lungo l’asse di legame.
E’ facile dimostrare che a seguito delle strutture spaziali, mentre nel metano i 4 vettori si annullano nell’ammoniaca questo non succede.
Per rendere quindi una molecola polare non è sufficiente la presenza di dipoli, ma anche che questi non si annullino reciprocamente.
La conoscenza della struttura tridimensionale di una molecola è quindi di notevole importanza per comprendere e prevedere se essa risulta polare o meno.
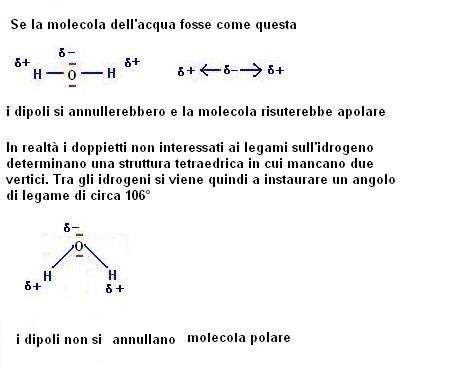
A tale riguardo un esempio fondamentale ci viene dall’acqua che come abbiamo visto è una tipica molecola polare.
La formula chimica dell’acqua è H2O con l’ossigeno molto più elettronegativo dell’idrogeno.
Nell’acqua ci sono quindi due dipoli (legati ai due legami tra idrogeno ed ossigeno), che se risultassero perfettamente opposti determinerebbero la apolarità della molecola.
Per comprendere il motivo per cui l’acqua sia polare dobbiamo ritornare a valutare il numero di orbitali che circondano l’ossigeno
E’ da notare che i solidi ionici (ad esempio NaCl) che pur hanno elevati punti di fusione si disgregano in genere facilmente in solventi polari come l’acqua.
Questo perché i centri dipolari si orientano sui cationi (anioni e cationi)di carica opposta, riducendo l’entità delle interazioni ioniche e determinando il collasso e quindi la dissoluzione del solido ionico.
Non tutte le molecole sono in assoluto polari o apolari, alcune di esse come ad esempio l’alcool possono avere al loro interno sia zone polari che zone apolari.
Questo spiega ad esempio come mai l’alcool sia solubile sia in solventi polari (come l’acqua) che in solventi apolari (come la benzina).