vedi anche pagine libro: da 43 a 47
Le proteine sono macromolecole di notevole importanza che svolgono importanti ruoli strutturali (muscoli e tessuti) e metabolici (enzimi e alcuni ormoni).
Esse vengono sintetizzate attraverso un meccanismo piuttosto complesso che parte dal DNA, passa attraverso diverse forme di RNA e arriva alla produzione di specifiche proteine.
La relazione diretta tra codice genetico e proteine indica l’elevata importanza biologica che esse manifestano.
Le proteine sono costituite da catene di aminoacidi, ogni aminoacido è unito al successivo tramite un legame denominato peptidico per questo motivo le proteine possono essere anche definite polipeptidi.
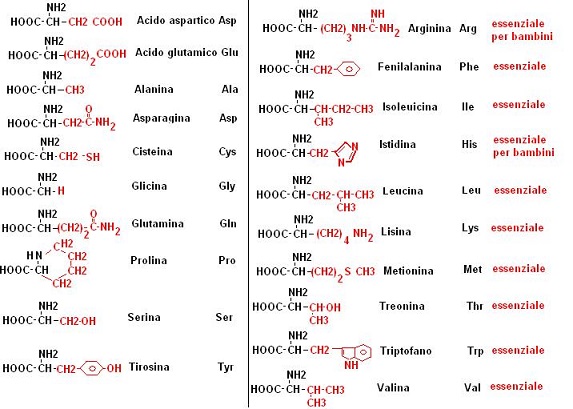
Le proteine presenti in natura sono costituite da 20 aminoacidi, cosi come tutte le parole che conosciamo sono costituite da un numero limitato di lettere.
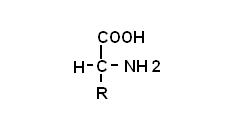
Gli aminoacidi sono molecole che al loro interno contengono un gruppo carbossilico (COOH) ed un gruppo aminico (NH2).
Gli aminoacidi naturali hanno delle caratteristiche comuni, che passiamo ad illustrare
1) Formula generale
2) il gruppo carbossilico ed il gruppo aminico sono uniti allo stesso atomo di carbonio
3) il gruppo R contraddistingue un aminoacido da un altro
4) salvo la glicina (aminoacido con R=H) il carbonio unito al gruppo carbossilico e aminico presenta caratteristiche chirali, per tanto gli aminoacidi sono quasi tutti otticamente attivi.
Gli aminoacidi naturali sono tutti stereoisomeri della serie L.
Il nostro organismo non è in grado di sintetizzare tutti i 20 aminoacidi naturali, per tanto alcuni di essi devono necessariamente essere assunti tramite la dieta. Questi aminoacidi vengono definiti essenziali e le proteine che li contengono vengono definite “proteine nobili”.
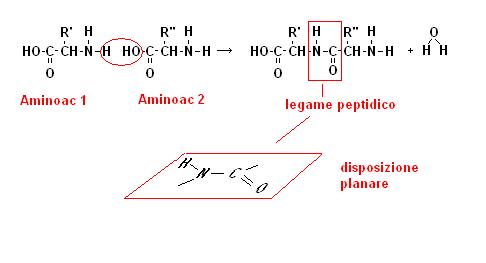
Abbiamo detto che due aminoacidi si uniscono attraverso un legame peptidico.
Il legame peptidico è il legame che si forma tra il gruppo carbossilico di un aminoacido e il gruppo aminico di un altro.
Poiché gli atomi interessati al legame peptidico si dispongono su di un piano, e dato che nelle proteine c’è una successione continua di legami peptidici, possiamo immaginare la seguenza di aminoacidi di una proteina come una seguenza di piani inclinati in cui escono i gruppi R caratterizzanti gli aminoacidi.
Definiamo struttura primaria, la sequenza di aminoacidi presenti in una proteina
Per convenzione la struttura primaria delle proteine si scrive partendo dall’aminoacido con il gruppo aminico libero a sinistra e quello con il gruppo carbossilico libero a destra.
Esempio di struttura primaria:
(a.acido con gruppo NH2 libero) Ala – Gli – Ala – Pro- Trp -Tyr (a.acido con gruppo COOH libero)
La struttura primaria delle proteine è codificata dal DNA
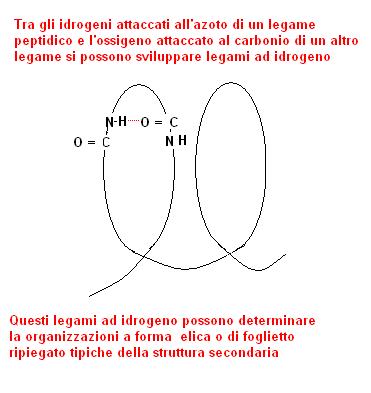
I residui laterali R di aminoacidi presenti nella proteina possono sovente dare legami ad idrogeno che determinano quella che viene considerata la struttura secondaria della proteina.
Tipiche strutture secondarie sono quelle ad elica o a foglietti ripiegati
Altri tipi di interazioni chimiche tra residui aminoacidici (in special modo legami S-S tra residui di cisteina) possono determinare il ripiegamento della struttura in forma globulari che identificano la struttura terziaria delle proteina.
Infine diversi residui polipeptidici possono unirsi tra di loro per dare luogo a proteine oligomeriche (ad esempio l’emoglobina è formata da 4 unita polipeptidiche distinte). L’unione di unità polipeptidiche diverse stabilisce la struttura quaternaria delle proteine.

Le proteine possono unirsi anche a molecole di altra natura, in questo caso vengono definite proteine composte o coniugate (dalla loro scissione non si ottengono solo gli aminoacidi).
Esempi di proteine coniugate sono:
Glicoproteine (proteine con zuccheri)
Lipoproteine (proteine con lipidi)
Fosfoproteine (contengono gruppi fosforici)
Cromoproteine (contengono di metalli, ad esempio clorofilla che contiene Mg o emoglobina che contiene ferro)
Il gruppo con caratteristiche non aminoacidiche presenti nella proteina viene chiamato gruppo prostetico.
Le proteine dalla cui scissione si ottengono solo aminoacidi vengono definite proteine semplici.
Le proteine semplici possono essere fibrose (dotate si sola struttura primaria e secondaria) o globulari (hanno anche struttura terziaria ed eventualmente quaternaria).
Le proteine fibrose vengono anche chiamate scleroproteine tra di esse troviamo ad esempio la cheratina (unghie, capelli, lana) ed il collagene (tessuti connettivi) …
Le proteine globulari vengono classificate in funzione della loro solubilità in:
1. albumine, solubili in acqua
2. globuline, poco solubili in acqua
3. glutenine, solubili in acidi e basi
4. prolamine, solubili in alcool
5. istoni, proteine a basso peso molecolare e carattere basico
Le proteine possono subire notevoli trasformazioni a seguito di trattamenti termici, chimici o azione di radiazioni. Questi effetti determinano modifiche che possono essere a livello di tutte e quattro le strutture caratterizzanti le proteine determinando la “denaturazione proteica”.
In genere i fenomeni di denaturazione contribuiscono a migliorare la digeribiltà delle proteine, ma possono anche determinare fenomeni indesiderati. Ad esempio se le proteine contengono molti aminoacidi solforati (cisteina e metionina) dalla loro denaturazione si può liberare H2S con caratteristico odore di uovo marcio.
Gli enzimi
Gli enzimi sono sostanze proteiche che esercitano importanti funzioni catalitiche nei processi metabolici.
In genere gli enzimi sono proteine complesse (spesso cromoproteine) con struttura terziaria e quaternaria.
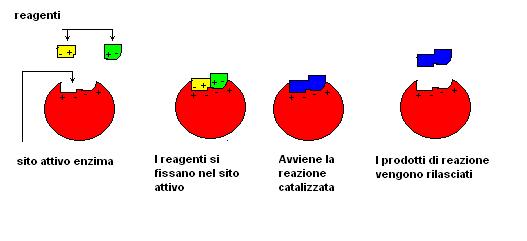
Gli enzimi tridimensionalmente vengono ad acquistare una struttura spesso vagamente sferica con delle zone (siti attivi) dove avviene l’azione catalitica.
Il sito attivo di un enzima può essere paragonato ad una serratura elettronica dove soltanto molecole con una specifica forma e carica elettrica possono essere caricate.
Questo fatto spiega come mai gli enzimi siano molto spesso estremamente selettivi, cioè esercitino la loro funzione solo alcune molecole e non su altre molto simili.
Ad esempio può capitare che solo una forma otticamente attiva subisca un processo enzimatico, mentre il suo enantiomero (immagine speculare) non venga riconosciuto.
Nel sito attivo vengono ospitate le molecole la cui reazione viene catalizzata dall’enzima.
Come abbiamo già detto gli enzimi sono spesso proteine complesse, nelle quali troviamo cioè anche una parte non costituita da aminoacidi.
Si tratta molto spesso di piccole molecole organiche, ioni metallici o combinazione di molecole organiche più ioni metallici che prendono in genere il nome di coenzimi o cofattori.
Questi coenzimi spesso non sono sintetizzati dall’organismo e devono essere assunti attraverso la dieta. Come vedremo molte vitamine contengono coenzimi necessari per esplicitare le funzioni enzimatiche.
Durante il corso avremo occasione di esaminare diversi enzimi e coenzimi.
La nomenclatura degli enzimi si basa sul tipo di reazione che essi compiono ed il substrato su cui essi agiscono.
L’alcool deidrogenasi (nome sistematico Alcool NAD+ ossidoriduttasi) è ad esempio un enzima che opera una deidrogenazione (eliminazione di idrogeno, quindi riduzione) dalla molecola di alcool etilico grazie alla azione del coenzima NAD+.
Sulla base delle reazioni che possono eseguire gli enzimi sono stati suddivisi in 6 classi:
1. Ossidoriduttasi (fanno reazioni di ossidoriduzione)
2. Transferasi (trasferiscono un gruppo funzionale da una molecola all’altra, ad esempio le transaminasi del fegato)
3. Idrolasi (scindono dei legami in genere con l’ausilio di acqua)
4. Liasi (agiscono sui doppi legami, favorendo l’addizione su di essi di una molecola oppure la loro loro formazione)
5. Isomerasi (favoriscono la formazione di isomeri, ad esempio fosfofrutto isomerasi catalizza la trasformazione di un derivato fosforilato del fruttosio in un derivato fosforilato del glucosio)
6. Ligasi o sinteasi (favoriscono le reazioni che portano alla unione di due molecole.