Gli stati fisici della materia
Nella nostra esperienza comune consideriamo la materia in natura sotto tre forme principali:
- Solido
- Liquido
- Aeriforme
Il nostro cervello è talmente abituato a operare le distinzioni tra solidi, liquidi e gas, che ci può risultare difficile spiegare quali siano le caratteristiche distintive di questi tre stati fisici.
Una caratterizzazione abbastanza efficace può essere quella del comportamento che solidi, liquidi e aeriformi hanno quando vengono trasferiti in un contenitore.
I solidi mantengono la loro forma ed il loro volume, i liquidi mantengono il loro volume, ma assumono la forma del contenitore in cui sono stati versati, i gas, infine oltre ad assumere la forma del contenitore in cui sono stati trasferiti ne occupano l’intero volume.
Questo comportamento è legato alle interazioni che le particelle hanno nei tre stati.
Nei solidi le interazioni sono molteplici, la struttura è quindi rigida, nei liquidi queste interazioni sono limitate, da cui un adattamento al contenitore, mentre nei gas le interazioni sono assenti per cui tutte le particelle sono libere di vagare nello spazio messo a loro disposizione.
Ovviamente ci sono altri aspetti caratterizzanti dei tre stati fisici, che volendo essere pignoli non sono neanche gli unici.
Alcuni materiali, infatti, presentano caratteristiche intermedie che li rendono difficilmente classificabili, basti pensare ai cristalli liquidi ad una fiamma solo per fare alcuni esempi.
Per i nostri studi in ogni caso potremo limitarci ai tre stati fondamentali.
Passiamo ora a definire che cosa intendiamo come SISTEMA.
Come sistema intendiamo l’oggetto delle nostre osservazioni.
Un sistema può essere quindi un bicchiere d’acqua, inteso come vetro + acqua, ma anche, se noi restringiamo il campo di osservazione, solo l’acqua contenuta nel bicchiere.
Tutto ciò che è esterno al sistema viene considerato AMBIENTE
Il sistema può essere aperto è quindi scambiare materia e/o energia con l’ambiente, oppure può essere chiuso.
Un’altra definizione che ci interessa per i nostri studi è la distinzione esistente tra grandezze intensive e grandezze estensive.
Sono grandezze estensive le grandezze che dipendono dalla quantità di materia, ad esempio la lunghezza, la massa, il peso, il calore etc.
Sono grandezze intensive quelle che invece non dipendono dalla quantità di materia, ad esempio la densità di un m3 di acqua è la stessa di un litro di acqua, il punto di fusione dell’acqua è indipendente dalla quantità di acqua che prendiamo in esame e così via.
In linea di massima quasi tutte le grandezze intensive sono caratterizzanti di un materiale, mentre le grandezze estensive non lo sono.
Se ad esempio misuro il peso specifico di un metallo posso affermare che se è differente da quello del ferro, l’oggetto su cui ho eseguito la misurazione non è quel genere di metallo.
La misura di un Kg di metallo non mi da invece nessuna informazione sulla natura del materiale.
Torniamo ora al nostro “sistema” acqua contenuta nel bicchiere.
In primo luogo possiamo osservare che in ogni punto del nostro sistema lo stato fisico è quello liquido, se poi prendiamo due porzioni casuali notiamo che esse hanno le stesse proprietà intensive
Abbiamo quindi una regione del nostro sistema che presenta stesso stato fisico e stesse proprietà intensive, questa regione si chiama FASE.
Se un sistema, come nel nostro esempio, è costituito da un’unica fase detto sistema si definisce OMOGENEO.
Se in un sistema sono presenti più fasi, ad esempio se allarghiamo i confini de sistema alle pareti di vetro, il sistema diventa ETEROGENEO.
Non è detto che un sistema per essere omogeneo deve essere costituito da una sola sostanza.
Se ad esempio sciogliamo del sale in acqua (e questa dissoluzione è completa) otteniamo una sola fase e per tanto ancora un sistema omogeneo.
Definiamo SOLUZIONE, un sistema omogeneo in cui un solvente (in genere liquido) discioglie completamente uno o più soluti che possono essere di natura solida, liquida o gassosa.
D’altro canto non è neppure detto che un sistema costituito da una sostanza pura sia per forza omogeneo.
Pensiamo ad esempio ad un bicchiere di acqua contenente un cubetto di ghiaccio.
Gli stati fisici presenti sono due, mentre la sostanza è una sola;
|
Stato fisico componente principale |
Stato fisico componente secondario |
Tipo di miscuglio |
Nome del miscuglio |
|
solido |
solido |
omogeneo |
Leghe (soluzioni solide) |
|
solido |
solido |
eterogeneo |
Rocce, miscugli |
|
solido |
liquido |
eterogeneo |
Fanghi |
|
solido |
aeriforme |
eterogeneo |
Spugne |
|
liquido |
solido |
omogeneo |
Soluzioni |
|
liquido |
solido |
eterogeneo |
Sospensioni |
|
liquido |
liquido |
omogeneo |
Soluzioni |
|
liquido |
liquido |
eterogeneo |
Emulsioni |
|
liquido |
aeriforme |
omogeneo |
Soluzioni |
|
liquido |
aeriforme |
eterogeneo |
Schiume |
|
aeriforme |
solido |
eterogeneo |
Fumo |
|
aeriforme |
liquido |
eterogeneo |
Nebbie |
|
aeriforme |
aeriforme |
omogeneo |
Miscela gassosa |
Le tecniche di separazione
Come TECNICHE DI SEPARAZIONE, intendiamo le operazioni che servono per separare i componenti di un miscuglio sia che esso sia omogeneo che eterogeneo.
Gran parte della industria alimentare e dell’industria farmaceutica si basano su operazioni di separazione/purificazione delle sostanze.
Affinché una tecnica di separazione sia efficace deve sfruttare delle caratteristiche diverse (proprietà intensive) dei componenti del sistema.
Possiamo quindi costruire una tabella in cui per ogni tecnica, possiamo associare la differente proprietà fisica sfruttata e il tipo di miscuglio su cui essa è applicabile.
Filtrazione: la filtrazione è una tecnica di separazione che viene applicata su miscugli eterogenei liquido – solido e sfrutta le diverse dimensioni specifiche delle particelle.
Le particelle solide, le quali presentano quasi sempre dimensioni maggiori di quelle delle particelle liquide, vengono trattenute da filtri e quindi allontanate dal miscuglio.
Il laboratorio la filtrazione viene applicata di frequente e sarà oggetto di una specifica esperienza.
Il problema principale della filtrazione è la lentezza, in taluni casi si può ricorrere a dei sistemi per velocizzarla ad esempio applicando il vuoto, ma come vedremo ci sono altri sistemi che consentono di separare solidi da liquidi velocemente.
Decantazione: anche la decantazione consente la separazione di miscugli eterogenei solido liquido, ma a differenza della filtrazione sfrutta il differente peso specifico.
Se la differenza tra peso specifico del solido e del liquido non è elevata la decantazione diventa difficile e anche molto lenta.
Centrifugazione: la forza che consente la decantazione è la forza di gravità.
Detta forza non è ovviamente modificabile (a meno di non andare su di un altro pianeta), ma ciò non toglie che noi possiamo applicare al nostro sistema una forza diversa da quella gravitazionale.
Con la centrifugazione al sistema viene applicata una forza (centrifuga) che dipendendo dal numero di giri può essere variata a piacimento.
In questo modo possiamo velocizzare notevolmente il fenomeno di decantazione ed operare una rapida separazione di miscugli eterogenei solido liquidi.
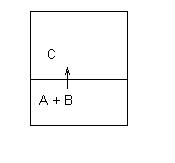
Estrazione con solvente: supponiamo di avere un sistema costituito da due sostanze A + B, a questo sistema aggiungiamo una terza sostanza C insolubile in A
Si otterrà un miscuglio eterogeneo (vedi figura).
Se la sostanza B mostra una maggiore affinità (solubilità) in C di quanto ne abbia con A , con il passare del tempo noteremo la migrazione di B dalla fase A alla fase C (senso della freccia).
L’estrazione con solvente è una operazione che facciamo più spesso di quanto pensiamo.
La smacchiatura di un tessuto, la preparazione di una tazza di tè o di caffè sono tutti esempi di estrazione con solvente.
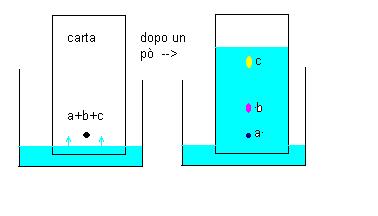
Cromatografia su carta: Supponiamo di avere un inchiostro (miscuglio omogeneo) composto da tre sostanze colorate.
Facciamo una macchia con questo inchiostro su un foglietto di carta ed immergiamo il foglietto stesso in un bicchiere contenente un solvente.
La macchia deve essere fatta in modo da non essere direttamente a contatto con il solvente, ma ad un livello leggermente superiore
La carta assorbirà il solvente che inizierà a salire per capillarità.
Poichè ogni componente della macchia ha una diversa tendenza a restare fissato sulla carta ed ad essere solubilizzato dal solvente dopo un certo periodo di tempo si noterà la scomposizione del miscuglio nei suoi tre componenti.
Nell’esempio A ha molta tendenza ad essere fissato sulla carta e poca solubilità nel solvente, C ha caratteristiche inverse a quelle di A, mentre B ha caratteristiche intermedie tra quelle di A e C.
La cromatografia quindi sfrutta la diversa affinità dei vari componenti di un sistema nei riguardi di una fase fissa (nell’esempio la carta) e di una fase mobile (nell’esempio il solvente liquido).
Esistono vari tipi di cromatografia classificabili a seconda dello stato fisico delle fasi (liquido-liquido, solido-liquido …) o del supporto fisso (su carta, su colonna, su strato sottile etc).
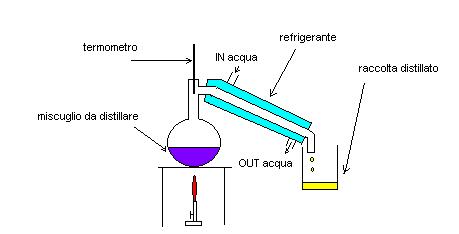
Distillazione: Quando i componenti di un miscuglio (anche omogeneo) hanno punti di ebollizione diversi è possibile separarli attraverso la distillazione.
Questa tecnica necessita di un apparecchio simile a quello della immagine seguente
Nel pallone viene messo il miscuglio che si vuole separare, supponiamo ad esempio un miscuglio omogeneo di acqua e alcool.
La temperatura di ebollizione del miscuglio dipenderà dalla composizione della miscela.
I vapori che si formano però saranno più ricchi del componente più volatile (alcool).
Man mano che ci allontaniamo dalla fonte di calore la temperatura diminuirà, per cui i vapori del componente meno volatile (acqua) condenseranno e ricadranno nel recipiente riscaldato.
Mentre i vapori si arricchiscono in alcool, il liquido in ebollizione si arricchisce in acqua.
Giunti nel tubo refrigerante anche i vapori ricchi in alcool, trovando una temperatura decisamente bassa, condenseranno e cadranno per gravità nel secondo contenitore.
Attraverso il termometro sarà possibile seguire le fasi della distillazione, in quanto la temperatura di ebollizione della miscela si avvicinerà sempre di più a quella dell’acqua pura, raggiunti i 100 °C potremo dire che tutto l’alcool è stato allontanato.
Elementi e composti
Abbiamo visto come attraverso le tecniche di separazione sia possibile separare i diversi componenti di miscugli sfruttando diverse proprietà fisiche della materia.
In effetti, tutte le tecniche di separazione possono essere considerate trasformazioni fisiche.
In una trasformazione fisica la natura chimica dei componenti del sistema non cambia, il numero di sostanze che ho all’inizio della trasformazione è sempre lo stesso che trovo al termine della stessa.
Ad esempio posso partire da acqua solida e trovare del vapore (cambio di stato fisico ma stessa sostanza) oppure posso partire da un miscuglio di tre sostanze e ottenerle alla fine separate.
Possiamo perciò affermare che il risultato ultimo di una serie di tecniche di separazione è quello di ottenere delle sostanze pure da dei miscugli utilizzando trasformazioni fisiche.
Il metodo più semplice per stabilire se una sostanza sia pura o meno è quello di controllare le sue proprietà fisiche caratteristiche, ad esempio punto di fusione di ebollizione etc.
Se esse non corrispondono possiamo essere certi che la sostanza in esame non è pura.
Una volta ottenuta una sostanza pura possiamo però chiederci se da essa sia possibile ottenere altre sostanze.
La risposta può essere positiva o negativa a seconda della sostanza in esame.
Definiamo COMPOSTI le sostanze pure che possono essere trasformate in altre più semplici attraverso delle trasformazioni chimiche.
Definiamo ELEMENTI le sostanze pure che NON possono essere trasformate in altre più semplici attraverso delle trasformazioni chimiche.
A differenza delle trasformazioni fisiche durante le trasformazioni chimiche il numero di componenti del sistema può variare, ad esempio da un composto si possono formare più elementi.
Inoltre le proprietà fisiche dei componenti puri che si ottengono alla fine della trasformazione sono diverse da quelle dei componenti puri che avevamo all’inizio.
Se decomponiamo ad esempio l’acqua (composto) in idrogeno ed ossigeno (elementi) da una sostanza liquida a temperatura ambiente ne troviamo due che in queste condizioni termiche sono aeriformi.
In natura ci sono una novantina di elementi più altri prodotti artificialmente in laboratorio, questi elementi sono come dei mattoncini che costituiscono tutta la materia che ci circonda.
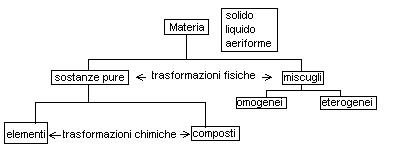
Il seguente schema sintetizza la classificazione della materia trattata in questa unità didattica