Una soluzione è un particolare esempio di miscuglio omogeneo formato da uno o più soluti miscibili in un solvente.
Nella casistica più comune i soluti sono solidi solubili, ma possiamo avere casi in cui il soluto è rappresentato da un liquido miscibile (ad esempio soluzioni idroalcoliche).
Il solvente più comune è l’acqua e in questa trattazione ci riferiremo sempre a soluzioni acquose.
Una soluzione può essere quindi considerata come un sistema omogeneo che contiene almeno due componenti una delle quali è il solvente.
Come concentrazione esprimiamo in generale il contenuto di un soluto per unità di peso o di volume di soluzione (che ricordiamo essere costituita da soluti + solvente).
E’ possibile esprimere la concentrazione in varie forme, in questa sede prenderemo in considerazione l’espressione della concentrazione sottoforma di:
- Percentuali (Peso/Peso, Peso/Volume o Volume/Volume)
- Molarità
- Normalità
La concentrazione in termini percentuali.
Immaginiamo di prendere dello zucchero e di scioglierlo in acqua.
La cosa più semplice da fare per esprimere la concentrazione sarà quella di definire i grammi di zucchero che abbiamo sciolto in un volume complessivo di 100 ml.
In questo caso abbiamo stabilito una percentuale peso / volume , riferendoci ai grammi di soluto (quindi un peso) disciolti in un volume di soluzione.
Se il soluto avesse l’aspetto di un liquido (ad esempio alcool) risulterebbe più pratico stabilire i ml di soluto sciolti in 100 ml di soluzione ed in questo caso dovremmo riferirci alla percentuale volume / volume.
NB I gradi alcolici sono corrispondenti ad una percentuale volume/volume, per cui una birra con 4° corrisponde ad un contenuto di 4 ml di alcool ogni 100 ml di bevanda (in pratica costituita da 96 ml di acqua e 4 di alcool)
Esiste in fine la percentuale peso/ peso che esprime i grammi di soluto ogni 100 grammi di soluzione.
Questo tipo di percentuale è frequentemente utilizzata per la commercializzazione di reagenti chimici concentrati.
Ad esempio l’acido cloridrico concentrato che si trova in commercio viene venduto al 36% che corrisponde a 36 grammi di HCl su 100 g di soluzione.
La conversione di una forma di percentuale ad un altra richiede la conoscenza o della densità del soluto o della densità della soluzione o di entrambi i valori.
Sapendo che:
densità = massa / volume
avremo:
% P/V = % V/V . densità soluto
% P/P = % V/V . densità soluto/densità soluzione
% P/P = % P/V : densità soluzione
E’ interessante notare che nota la concentrazione e la quantità si soluzione è sempre possibile risalire alla quantità di soluto.
Se volessimo infatti sapere quanti grammi di zucchero ci sono in un litro di soluzione al 10% P/V
dovremmo semplicemente fare la seguente operazione:
10 g di zucchero : 100 ml di soluzione = x g di zucchero : 1000 ml di soluzione (1 l)
x = 100 g
In pratica la proporzione appena effettuata equivale a dire:
grammi di soluto = (% P/V . volume soluzione in ml) / 100 = 10 . 1000 / 100 = 100 grammi
La Molarità
La molarità rappresenta la forma più comune con la quale i chimici esprimono la concentrazione.
In termini pratici la molarità (che si indica con M ) esprime le moli di soluto contenute in un litro di soluzione, ossia
M = moli / V (litri)
Se ad esempio prendiamo 0,3 moli è le sciogliamo in 250 ml di soluzione avremo una molarità pari a:
M = 0,3 moli / 0,25 litri = 1,2
Nota la natura del soluto potremo conoscere il suo peso molecolare e di conseguenza risulterà .
estremamente facile passare dal contenuto in grammi di un soluto alla sua concentrazione molare.
Immaginiamo di sciogliere 10 grammi di zucchero (formula chimica C12H22O11 pm = 342) in 50 ml di acqua e di voler calcolare la molarità
moli = grammi / Pm = 10g / 342 g/moli = 0,029 moli
Molarità = moli / V(l) = 0,029 moli /0,05 litri = 0,58
L’uso della molarità è molto importante anche per i calcoli stechiometrici delle reazioni chimiche
Consideriamo ora una reazione chimica già bilanciata ad esempio:
2NaOH + H2SO4 -> Na2SO4 + 2H2O
Supponiamo di avere:
Una soluzione 0,23M di NaOH
Una soluzione 0,15M di H2SO4
Ci chiediamo quanti ml di H2SO4 reagiscono con 20 ml di NaOH
Il problema si risolve nella seguente maniera
1) si calcolano le moli di NaOH contenute nei 20 ml di soluzione
moli = M . V(l) = 0,23 moli/l . 0,02 l = 0,0046 moli
2) si guardano i coefficienti della reazione bilanciata
2 moli di NaOH reagiscono con una mole di H2SO4
avendo 0,0046 moli le moli di H2SO4 che reagiranno saranno:
moli di H2SO4 = 0,0046/2 = 0,0023
3) note le moli e la molarità dell’acido solforico possiamo calcolare il volume:
V (l) = moli/ M quindi
volume H2SO4 che reagisce con NaOH = 0,0023 moli / 0,15 moli/l = 0,0153 litri = 15,3 ml
Un problema che sovente può capitare in laboratorio è la conversione della percentuale P/P in molarità. Abbiamo detto infatti che i reagenti chimici concentrati vengono commercializzati esprimendone il titolo (concentrazione) in %P/P.
Supponiamo di trovarci di fronte dell’HCl conc al 36% P/P (densità soluzione = 1,180 g/ml) e di volerne calcolare la molarità.
Ecco come si procede:
- determiniamo il peso molecolare del soluto, in questo caso HCl pm =36,5
- determiniamo le moli di soluto contenute in 100g di soluzione.
36 g di HCl quindi: moli = 36g/36,5g/moli = 0,986
abbiamo quindi 0,986 moli / 100 g di soluzione.
- stabiliamo il volume in millilitri corrispondente ai 100 g di soluzione.
La densità esprime il rapporto tra massa e volume (d = M/V) ne consegue che il volume si ottiene dalla relazione V = Massa / d
Massa = 100 g di soluzione d = 1,180 g/ml V = 100 g / 1,180 g/ml =84,75
- calcoliamo la molarità
Sappiamo ora sia le moli di soluto che il volume di soluzione, sapendo che la M = moli / V(l), dovremo fare:
Molarità = 0,986 moli HCl / 0,08475 ml di soluzione = 11,63 M
NB commercialmente i principali acidi concentrati (HCl, HNO3 e H2SO4) vengono venduti con una molarità di circa 12. Ne consegue che in termini di percentuale P/P risulteranno avere dei valori prossimi al loro penso molecolare (vedi esercizio appena svolto) ad esempio:
Acido cloridrico concentrato (pm = 36,5) 36%
Acido nitrico concentrato (pm = 65) 65%
Acido solforico concentrato (pm 98) 98%
Ricordatevi quindi che acido cloridrico al 36% e acido nitrico al 65 % sono da considerarsi molto concentrati
La Normalità
La normalità rappresenta un altro modo con il quale i chimici indicano la concentrazione.
In termini effettivi la normalità, che si indica con la lettera N, esprime gli equivalenti di soluto contenuti in un litro di soluzione
N = equivalenti / V(l)
Appare evidente la necessità di definire cosa siano gli equivalenti.
Diciamo subito che l’equivalente è un artificio usato dai chimici per “semplificare” i calcoli stechiometrici delle reazioni chimiche.
Torniamo a considerare la reazione:
2NaOH + H2SO4 -> Na2SO4 + 2H2O
In termini di moli dovremo dire:
2 moli di idrossido di sodio reagiscono con una mole di acido solforico per dare una mole di solfato di sodio e due moli di acqua.
Se ragioniamo in termini di equivalenti diremo: un equivalente di idrossido di sodio reagisce con un equivalente di acido solforico per dare un equivalente di solfato di sodio ed un equivalente di acqua.
In altre parole parlando di equivalenti non abbiamo più la necessità di bilanciare le reazioni in quanto i rapporti di reazione sono sempre 1:1.
Per calcolare gli equivalenti di una sostanza partendo dai grammi bisogna applicare questa relazione
equivalenti = g / peso equivalente
Tenendo presente che per calcolare il peso equivalente dovremo applicare la seguente relazione:
peso equivalente = peso molecolare / valenza operativa
La valenza operativa è un valore che dipende dalla sostanza in questione e dal tipo di reazione che essa deve subire.
Per le reazioni che abbiamo fino ad ora visto la valenza operativa può essere intesa come cariche positive (o negative) che si liberano dalla dissociazione di una mole di sostanza.
Per le reazioni di ossidoriduzione, che verranno trattate più avanti, la valenza operativa rappresenta gli elettroni scambiati da un mole di sostanza.
Facciamo un esempio pratico
|
sostanza |
specie chimiche dalla dissociazione |
cariche positive |
cariche negative |
valenza operativa |
peso equivalente |
|
HCl |
H+ Cl– |
1 |
1 |
1 |
p.molec / 1 |
|
H2SO4 |
2H+ SO4— |
2 |
2 |
2 |
p.molec / 2 |
|
AlPO4 |
Al+++ PO4— |
3 |
3 |
3 |
p.molec / 3 |
E’ possibile stabilire una relazione diretta tra molarità e normalità con la seguente espressione
N = M . valenza operativa
(puoi provare per ricordarti questa relazione a pensare alla frase “Non Mi Va“(normalità = molarità . valenza)
Proviamo a risolvere lo stesso problema visto nel caso della molarità con la normalità
dati problema :
reazione chimica 2NaOH + H2SO4 -> Na2SO4 + 2H2O
Una soluzione 0,23M di NaOH
Una soluzione 0,15M di H2SO4
Ci chiediamo quanti ml di H2SO4 reagiscono con 20 ml di NaOH
Il problema si risolve nella seguente maniera
1) Trasformiamo le molarità in normalità
NaOH -> Na+ + OH– valenza operativa = 1 N = M .1 = 0,23 .1 = 0,23
H2SO4-> 2H+ + SO4— valenza operativa = 2 N = M .2 = 0,15 .2 = 0,30
2) Calcoliamo gli equivalenti
Per calcolare gli equivalenti nota la normalità faremo
equivalenti = N . V (l)
equivalenti di NaOH = 0,23 eq/l . 0,020 l = 0,0046
poiché il rapporto di reazione tra gli equivalenti è di 1:1
0,0046 saranno anche gli equivalenti di H2SO4
3) Calcoliamo il volume
V (l) = equivalenti/ N quindi
volume H2SO4 che reagisce con NaOH = 0,0046 eq / 0,30 eq/l = 0,0153 litri = 15,3 ml
stesso risultato ottenuto nel problema precedente
N.B Possiamo osservare come ragionando in equivalenti sia sempre possibile applicare per la risoluzione dei problemi la seguente relazione
N1V1 = N2V2 “il prodotto della normalità per il volume di ogni partecipante ad una reazione è costante (ricordiamo che moltiplicando la normalità per il volume in litri si ottengono gli equivalenti)”
Il problema che abbiamo visto poteva essere risolto con un solo passaggio
NacVac = NidrossVidross L’incognita è il Vac
Vac = NidrossVidross / Nac attenzione non è una proporzione
Vac = 0,23eq/l . 0,020 l / 0,30 eq/l = 0,0153 litri
Le proprietà colligative.
Le proprietà fisico-chimiche di una soluzione sono diverse da quelle delle sostanze che la compongono.
Noi sappiamo che l’acqua distillata ha un ben determinato punto di fusione e punto di ebollizione, ma cosa succede se aggiungiamo un soluto a dell’acqua distillata.
Sperimentalmente si è potuto osservare che indipendentemente dalla natura chimica del soluto aggiunto una soluzione rispetto al solvente puro ha un punto di ebollizione maggiore ed un punto di fusione minore e che questi effetti sono tanto maggiori quanto più elevata risulta la concentrazione.
Queste proprietà legate alla concentrazione delle soluzioni prendono il nome di proprietà colligative ed in particolare abbassamento crioscopico (diminuzione punto di fusione) ed innalzamento ebullioscopico (aumento punto di ebollizione).
Possiamo interpretare questi fenomeni come una sorta di interferenza che il soluto compie nei passaggi di stato del solvente, ad esempio rendendo più difficile la formazione di un reticolo cristallino di ghiaccio.
Le proprietà colligative spiegano diversi comportamenti pratici, ad esempio l’uso di spargere il sale nelle strade ghiacciate o il comportamento dell’acqua in ebollizione quando ci versiamo sopra del sale.
Un altro fenomeno legato alla concentrazione delle soluzioni è la pressione osmotica.
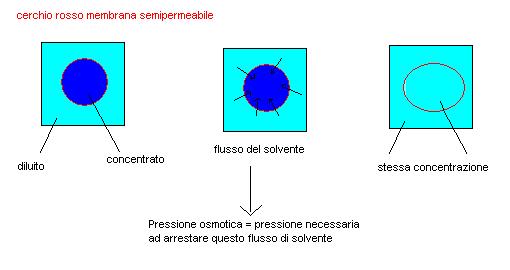
Per comprendere questo fenomeno dobbiamo definire che cosa sia una membrana semipermeabile.
Una membrana semipermeabile è una membrana che consente il passaggio del solvente ma trattiene il soluto.
Esempi di membrane semipermeabili sono le pergamene e numerose membrane cellullari.
Immaginiamo di avere ora una soluzione concentrata trattenuta all’interno di una membrana semipermeabile immersa in una soluzione diluita.
Sperimentalmente noteremo che con il passare del tempo le concentrazioni all’interno e all’esterno della membrana tenderanno a equipararsi (si dice che diventano isotoniche).
Affinché avvenga questa equiparazione di concentrazioni deve essere avvenuto un flusso di solvente dalla soluzione più diluita a quella più concentrata, ciò si osserva anche dall’ingrandimento delle dimensioni della membrana semipermeabile (turgore) .
Definiamo pressione osmotica la pressione necessaria per arrestare il flusso spontaneo di solvente dalla zona più diluita a quella più concentrata di un sistema separato da una membrana semipermabile.
La pressione osmotica è uno dei fenomeni più importanti in natura, ad esempio il flusso di liquidi attraverso le piante è in gran parte garantito da fenomeni osmotici.
La stessa osmosi spiega la perdita intracellulare di acqua in materiale organico posto in salamoia.