Il suolo oltre che ad essere un supporto meccanico per la vegetazione costituisce una riserva naturale di elementi minerali indispensabili per la crescita delle piante.
La composizione elementare del suolo e quella delle piante sono diverse è ovvio per tanto che quest’ultime assumono gli elementi in relazione alle loro funzioni biologiche e non in funzione della loro abbondanza.
Alla luce delle moderne conoscenze sono riconosciuti quindici elementi essenziali; di questi solo tre (C, H e O) provengono direttamente dalla atmosfera o dalle precipitazioni, mentre gli altri dodici derivano dal terreno.
Secondo la distinzione adottata anche dalla Legislazione (rif. GU 6/11/84) i dodici elementi di provenienza tellurica vengono distinti in:
· elementi principali N, P e K
· elementi secondari S, Ca e Mg
· microelementi Fe, Mo, Mn, Zn, Cu e B.
E’ importante sottolineare che questi elementi possono essere assorbiti dalle piante solo sotto particolari forme molecolari o ioniche e che quindi non sempre il contenuto di un elemento nel terreno rappresenta in toto il quantitativo assimilabile dalla pianta.
Le piante in genere assorbono gli elementi in forma ionica dalla soluzione del terreno attraverso le radici, anche se viene riconosciuta la capacità di assorbimento di altri organi (in particolare le foglie soprattutto nelle piante acquatiche).
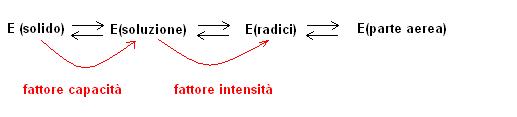
Nel suolo esiste un equilibrio dinamico che interessa la fase solida, la soluzione circolante ed i tessuti radicali
Fase solida <-> soluzione circolante <-> tessuti radicali
Sebbene i meccanismi di trasferimento degli ioni dal terreno alle piante non siano ancora completamente noti possiamo operare la seguente schematizzazione:
Indicando con E il movimento dal terreno alla pianta:
La fase solida è da considerarsi la riserva a breve termine degli elementi nutritivi.
La quantità di un elemento in grado di passare dalla fase solida a quella di soluzione viene definita CAPACITA’ e si identifica con le forme scambiabili o facilmente solubili.
La capacità è influenzata dalla natura del suolo e dal volume del suolo esplorato dalle radici.
Il passaggio degli ioni dalla soluzione alle radici è invece molto legato alla concentrazione dello
ione definito INTENSITA’.
L’assorbimento ionico della pianta comporta quindi una migrazione continua in cui gioca un importante ruolo il cosiddetto POTERE TAMPONANTE IONICO DEL SUOLO, ossia la capacità del terreno di rifornire la soluzione circolante con uno ione di cui la soluzione stessa va impoverendosi.
Il potere tamponante ionico (relativo ad uno specifico elemento) può essere espresso come rapporto:
CAPACITA’/ INTENSITA’.
E’ importante considerare che nel meccanismo della nutrizione minerale si possono distinguere due fasi di assorbimento:
1. Assorbimento Passivo
2. Assorbimento o Trasporto Attivo.
L’assorbimento passivo è legato a fenomeni di diffusione.
La diffusione consiste in un movimento degli ioni dalle zone a maggiore concentrazione a quelle a minore concentrazione (si dice secondo gradiente di concentrazione).
Nei tessuti radicali possiamo distinguere una parte in cui il movimento degli ioni avviene liberamente nei due sensi (SPAZIO LIBERO APPARENTE) e nella quale ha sede l’assorbimento passivo.
Il trasporto passivo è quindi un fenomeno reversibile che risulta legato a flussi spontanei di massa ossia al moto dei soluti che avviene seguendo il flusso convettivo dell’acqua dal suolo all’apparato radicale.
Tuttavia poichè la soluzione circolante presenta delle concentrazioni ioniche notevolmente inferiori a quelle intracellulari dobbiamo ipotizzare che il trasporto di ioni all’interno delle piante debba seguire un meccanismo contro gradiente di concentrazione che non può essere spiegato dalla diffusione.
La membrana cellulare contiene una sorta di barriera, chiamate membrana cellulare di natura fosfolipidica che separa l’ambiente extracellullare da quello intracellulare (citoplasma).
La membrana cellulare è una barriera di tipo semipermeabile, ossia permeabile all’acqua, ma impermeabile agli ioni.
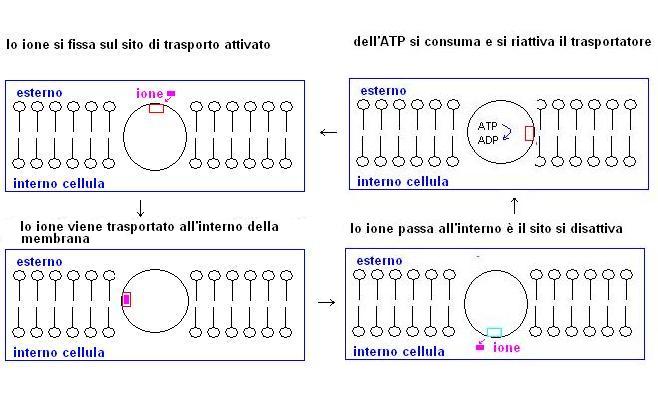
Per entrare all’interno della cellula quindi gli ioni richiedono dei meccanismi di trasporto che possono essere più o meno selettivi nei riguardi di uno specifico ione, ma che richiedono sempre una certa spesa energetica.
Il trasporto attivo rappresenta quindi un trasporto contro gradiente di ioni che avviene sempre con il consumo di energia.
Il consumo energetico cellulare è legato alla azione di una molecola chiamata ATP (adenosin trifosfato) che trasformandosi in ADP (adenosin difosfato) e fosforo libera una certa quantità di energia.
Il funzionamento di un sistema di trasporto attivo è più o meno il seguente:
Questo meccanismo può essere utilizzato anche per scambiare dei cationi tra l’interno è l’esterno della membrana .
Un esempio è già stato citato parlando delle cause dell’acidificazione del suolo dovuto alla attività dell’apparato radicale delle piante.
Dall’attività respiratoria delle cellule delle radici viene sviluppata anidride carbonica che con l’acqua produce acido carbonico.
L’acido carbonico si può dissociare liberando ioni H+ secondo la seguente reazione:
H2CO3 <-> H+ + HCO3–
Gli ioni H+ possono essere “pompati” fuori dalla cellula e scambiati con degli altri cationi presenti nella soluzione circolante.
L’AZOTO
L’azoto è il più importante dei macroelementi, entra a far parte degli acidi nucleici (DNA e RNA) e delle proteine.
Le piante assorbono l’azoto dal terreno prevalentemente in forma:
· nitrica (NO3–)
e solo in certi casi in forma
· ammoniacale (NH4+)
Le principali riserve di azoto nel suolo sono costituite dalla sostanza organica e dagli ioni ammonio fissati al complesso di scambio.
Nella sostanza organica l’azoto può essere presente in forme più o meno degradabili con un rapporto C/N≈10.
Nei terreni agrari il contenuto di azoto totale varia in media tra lo 0,1 e lo 0,15 %.
Gli apporti di azoto possono verificarsi sia per via naturali (ricircolo materiale organico) che a seguito di concimazioni.
Le esportazioni di azoto sono sensibilmente elevate nei terreni coltivati a seguito dell’allontanamento del raccolto, mentre in un bosco circa l’80% dell’azoto viene riciclato attraverso la caduta delle foglie.
Le perdite di azoto per dilavamento non sono elevate, ma hanno notevoli ricadute ambientali in quanto interessano quasi esclusivamente la forma nitrica (inquinamento delle acque).
In terreni basici diventano significative anche le perdite di azoto sottoforma di ammoniaca a seguito della trasformazione dello ione ammonio secondo la seguente reazione.
NH4+ + OH– -> NH3(gas) + H2O
Queste perdite diventano ancora maggiori a seguito dell’aggiunta di concimi ammoniacali (accumulo di ioni ammonio spostamento dell’equilibrio verso formazione di ammoniaca gassosa)
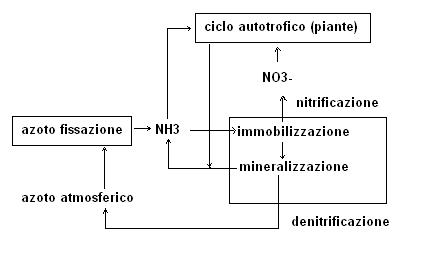
Il ciclo pedogenico dell’azoto
Il ciclo dell’azoto può essere suddiviso in diversi sottocicli
1. sottociclo elementare (fonte principale azoto elementare atmosferico)
2. sottociclo eterotrofico (dominato dall’attività di microrganismi eterotrofi)
3. sottociclo autotrofico (dominato dall’attività di piante superiori autotrofe).
IL SOTTOCICLO ELEMENTARE (AZOTOFISSAZIONE)
L’azoto sottoforma di molecola di N2 è contenuto nell’aria con una percentuale di circa l’80%.
La trasformazione dell’azoto atmosferico in forme combinate può essere di tipo biologico (naturale) e non biologico (industriale).
I processi non biologici sono legati alla attività umana e quindi connessi alla sintesi dell’ammoniaca e dei fertilizzanti (tratteremo questi processi più avanti).
I processi biologici possono essere condotti da m.o liberi nel terreno (azotofissazione libera) o da dei m.o simbionti (azotofissazione simbiontica).
Dal punto di vista agronomico il processo simbiontico è quello che risulta di maggiore importanza, infatti mentre gli azotofissatori liberi utilizzano l’azoto fissato per la loro crescita (cedendolo al terreno solo in seguito alla loro morte), gli azotofissatori simbionti cedono in pratica tutto l’azoto fissato alle piante (che in cambio cedono ai batteri carboidrati fotosintetizzati)
Vi sono quindi diversi batteri che possono fissare l’azoto atmosferico tra questi:
|
Liberi |
Simbionti |
|
|
aerobi |
anaerobi |
|
|
Azotobacter |
Clostridium |
Rhizobium |
|
Azotomonas |
|
Anabaena |
|
Bacillus |
|
Nostoc |
|
Nocardia |
|
|
|
Pseudomonas |
|
|
|
Klebsiella |
|
|
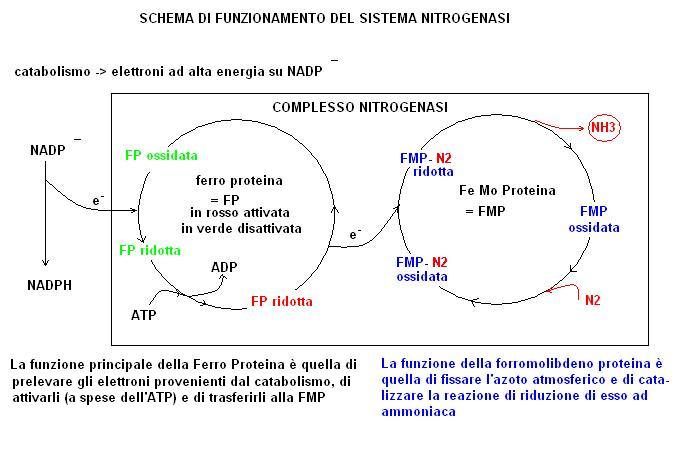
Il meccanismo di fissazione dell’azoto è pressoché comune ai diversi tipi di m.o e risulta legato all’azione di un complesso enzimatico chiamato NITROGENASI.
Gli enzimi sono i catalizzatori biologici è sono costituiti da proteine.
Un complesso enzimatico come la nitrogenasi risulta costituito da due proteine
· una ferro proteina (costituita da due subunità identiche)
· una ferro molibdeno proteina (costituita da quattro subunità)
La nitrogenasi è molto sensibile all’ossigeno che la disattiva per cui i m.o che la utilizzano hanno sviluppato dei meccanismi per impedire il contatto dell’enzima con l’ossigeno.
Ad esempio i Rhizobium che sono simbionti delle leguminose assimilano dalla pianta che contaminano una leghemoglobina, ossia una proteina che fissa l’ossigeno impedendo che questo elemento venga a contatto con la nitrogenasi.
Il meccanismo di funzionamento della nitrogenasi è piuttosto complesso e richiede una spesa energetica computabile in molecole di ATP consumate.
Il consumo delle molecole di ATP, e quindi la spesa energetica dell’azoto fissazione, non è lo stesso in tutti i m.o si passa dalle 5 molecole consumate dagli azotobacter alle 29 consumate dalle Klebsielle con un valore medio di circa 15 molecole di ATP.
Se valutiamo nel complesso la reazione di azoto fissazione possiamo notare come essa non sia altro che una reazione di riduzione (acquisto di elettroni)
N2 + 6e– + 6H+ -> 2NH3
La funzione del complesso nitrogenasi è proprio quella di fornire gli elettroni all’azoto per trasformarlo in ammoniaca.
Nei processi biologici gli elettroni provengono da reazioni di ossidazione a carico di sostanza organica.
In pratica la sostanza organica viene ossidata nella fase di respirazione (catabolismo) o di fermentazione attraverso delle reazioni spontanee che producono energia.
Il processo ha alcune similitudini con il funzionamento di una automobile, dove bruciando della benzina otteniamo l’energia necessaria per far girare il motore.
Nella macchina il processo di combustione produce però anche molto calore ed una forte dissipazione di energia.
Le cellule non hanno la possibilità di sopportare temperature elevate e tanto meno possono permettersi di dissipare molta energia.
L’energia ottenuta dai processi catabolici viene quindi “raccolta” sotto forma di elettroni ad altra energia che sono fissati su molecole (ATP, NADH, FADH citocromi etc)
All’occorrenza queste molecole energetiche cedono i loro elettroni ad altre molecole che si attivano e possono compiere quindi le loro funzioni.
Il meccanismo di funzionamento del complesso NITROGENASI è un buon esempio di quanto affermato.
SOTTOCICLO ETEROTROFICO MINERALIZZAZIONE ED IMMOBILIZZAZIONE
Questo sottociclo è essenzialmente condotto dai m.o che operano un continuo passaggio tra le forme inorganiche e organiche dell’azoto.
In inglese viene denominato con la sigla MIT (mineralization-immobilization-turnover).
Come mineralizzazione dell’azoto intendiamo tutta quella serie di reazioni che trasformano l’azoto organico in azoto ammoniacale.
Come immobilizzazione dell’azoto intendiamo, invece, tutte quella serie di reazioni che trasformano i composti inorganici (essenzialmente NH4+, NO3– e NO2–) in forme organiche.
Possiamo comprendere come in pratica mineralizzazione e immobilizzazione siano sostanzialmente dei processi opposti.
MINERALIZZAZIONE
Nei composti organici l’azoto può essere presente in diverse forme, ma a livello cellulare esso è presente essenzialmente nelle proteine.
Le proteine sono catene di amminoacidi la cui struttura di base è la seguente:
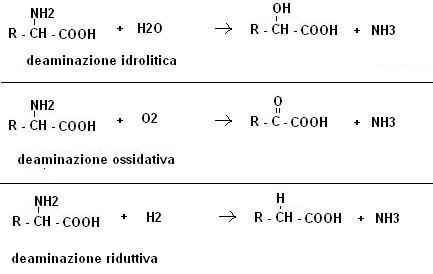
Il principale processo di mineralizzazione, che viene operato in maniera non specifica dai più diversi m.o (in particolare funghi in ambienti acidi e batteri in ambienti neutri o alcalini), consiste in una ammonizzazione, ossia nella liberazione di ammoniaca soprattutto da proteine.
In primo luogo le proteine vengono demolite per azione di specifici enzimi in amminoacidi, gli amminoacidi subiscono poi delle reazioni di deaminazione che portano allo sviluppo di ammoniaca; vediamo alcuni esempi:
L’ammoniaca che si forma in fase di mineralizzazione può quindi seguire diverse strade che sono alla base dei processi di immobilizzazione.
In ambiente fortemente anaerobio alcuni m.o utilizzano lo ione nitrato come fonte di ossigeno per ossidare la sostanza organica.
Questo tipo di respirazione anaerobia è alla base del processo di denitrificazione riassumibile da questa reazione schematizzata:
sostanza organica + NO3– -> CO2 + N2 + H2O + energia
attraverso questa reazione assistiamo alla restituzione alla atmosfera dell’azoto precedentemente fissato con l’azotofissazione
IMMOBILIZZAZIONE
Vediamo ora le strade che può seguire l’ammoniaca prodotta in fase di mineralizzazione
1. assorbimento diretto da parte dei vegetali (piuttosto raro)
2. assorbimento da parte dei m.o (riequilibrio rapporto C/N)
3. eliminazione sottoforma di ammoniaca gassosa (in terreni molto alcalini)
4. fissazione stabile nei reticoli cristallini dei silicati
5. scambio cationico come ione ammonio (non preclude il punto successivo)
6. ossidazione a nitrati NITRIFICAZIONE
La nitrificazione è un processo di notevole importanza in quanto salvo rari casi sono i nitrati che costituiscono la principale fonte di azoto per le piante superiori.
L’azoto nitrico, a differenza di quello ammoniacale, non viene adsorbito dai colloidi, e per questo rappresenta la forma più disponibile dalle piante.
D’altro canto per le stesse ragioni i nitrati (che sono solubili) risultano facilmente dilavabile dal terreno per cui è la parte ammoniacale a costituire la principale riserva di azoto nel terreno.
Il processo di nitrificazione avviene in realtà in due passaggi
· nitrosazione (conversione dell’ammoniaca a ione nitrito)
· nitrificazione (conversione dello ione nitrito in ione nitrato)
Entrambi questi due passaggi sono operati da m.o
La nitrosazione viene condotta principalmente da Nitrosomonas.
In questi batteri sono presenti enzimi nitrito ossidoriduttasi che conducono la seguente reazione complessiva:
2NH3 + 3O2 -> 2NO2– + 2H++ 2H2O + energia
Si tratta di un processo piuttosto lento attraverso il quale i m.o ottengono dell’energia
La nitrificazione vera e propria viene condotta principalmente da Nitrobacter .
Questi batteri tramite enzimi ossidasi operano la seguente trasformazione
2NO2– + 2O2 -> 2NO3– + energia
Sia l’attivita dei nitrosomonas che dei nitrobacter è influenzata dal clima (occorrono temperature maggiori di 10°C), dalla aerazione (sono m.o aerobi), trovano il loro optimum a pH 7,8 (non sono attivi in ambiente acido) e necessitano della presenza di ioni Ca++ per neutralizzare l’acido nitrico e nitroso che si forma (vedi effetto tampone)
SOTTOCICLO AUTOTROFICO
Responsabili di questo ciclo sono le piante (organismi autotrofi ossia che traggono la loro energia dal sole).
Le piante assimilano l’azoto derivante dal ciclo di azotofissazione e dal ciclo eterotrofico, lo utilizzano per le loro esigenze e lo restituiscono al terreno direttamente (caduta foglie, morte pianta etc) o indirettamente (nutrimento di animali che poi a loro volta con deiezioni o loro morte lo rendono al terreno).
Possiamo quindi riassumere il ciclo pedogenico dell’azoto con il seguente schema:
IL FOSFORO
Il fosforo è presente in diverse molecole di interesse biologico come acidi nucleici, fosfolipidi, ATP etc.
Nelle piante si può accumulare come sali di calcio e magnesio dell’acido inositolesafosforico (fitina).
Il fosforo viene assorbito dalle radici sono nel suo massimo stato di ossidazione come anione H2PO4– o HPO4— o PO4— a seconda del pH del mezzo.
Le diverse forme fosfatiche sono infatti in equilibrio tra di loro in funzione della concentrazione di idrogenioni e quindi del pH
H3PO4 <-> H2PO4– + H+ <-> HPO4— + H+ <-> PO4— + H+
ambiente acido <——————————> ambiente alcalino
un aumento dell’acidità sposta gli equilibri verso sinistra:
in pratica a pH=2 sarà prevalente la forma H2PO4–,
a pH=7 coesisteranno le forme H2PO4– e HPO4—,
mentre a pH=12 sarà prevalente la forma PO4— .
Conseguenza di questo fatto è che sia in ambiente acido che in ambiente basico tendono a formarsi fosfati insolubili (in ambiente acido fosfati di alluminio e ferro, mentre in ambiente basico fosfati di calcio e magnesio) che non sono più assimilabili dalle piante.
La disponibilità di fosforo per la vegetazione risulta quindi limitata ad un range di pH piuttosto limitato verso la zona di neutralità, nella quale i fosfati risultano solubili.
In terreni acidi o alcalini la disponibilità del fosforo è strettamente connessa all’azione dei microorganismi, dell’humus e degli apparati radicali.
L’azione biologica dei microorganismi e degli apparati radicali consente di modificare il pH anche solo localmente determinando microcondizioni che ottimizzano l’assorbimento dell’azoto.
Gli acidi umici possono chelare (sequestrare) alcuni ioni (quali alluminio, ferro, calcio e magnesio) impedendo la precipitazione dei relativi fosfati.
Il ciclo del fosforo interessa solo l’ambiente terrestre e acquatico non essendo presenti molecole contenenti questo elemento nell’atmosfera.
Possiamo schematizzare il ciclo nelle seguenti fasi
1. minerali fosfatici a seguito di agenti atmosferici rilasciano fosforo inorganico nel terreno o nelle acque
2. i microorganismi trasformano il fosforo inorganico in fosforo organico facendolo entrare nella catena alimentare
3. Gli esseri viventi con le loro deiezioni o con le loro spoglie restituiscono il fosforo al terreno
4. Attraverso reazioni di precipitazioni il fosforo nel terreno ridiventa insolubile e tende nel lungo periodo a riformare dei minerali
Il punto cardine del ciclo del fosforo è da far ricadere nella attività dei microorganismii quali possono giocare ruoli ambivalenti (sia positivi che negativi).
Il rapporto tra carbonio e fosforo nei processi di umificazione si stabilizza intorno ad un valore di 100.
L’azione microbica di umificazione su substrati organici con un rapporto C/P >100 porterà quindi alla sottrazione di fosforo dal terreno, il discorso sarà ovviamente opposto se l’umificazione parte da sostanze con rapporti C/P <100.
Tra le azioni positive dei microorganismi sull’assorbimento del fosforo troviamo:
· trasformazione dei metafosfati (usati come concimi) in ortofosfati (assimilati dalle piante)
· Dissoluzione dei fosfati cristallini attraverso l’azione di sottoprodotti acidificanti del loro metabolismo (CO2, H2SO4, HNO3)
· Azione sequestrante (acidi organici) nei riguardi dei metalli che portano alla precipitazione dei fosfati
Tra le azioni negative è possibile in ambienti anaerobi la trasformazione estremamente deleteria degli ortofosfati in fosfina (PH3)
E’ da sottolineare il fatto che il fosforo risulta scarsamente asportabile per liscivazione e di conseguenza le perdite sono imputabili prevalentemente ai raccolti.
Il ciclo del fosforo è sostanzialmente rappresentativo dei cicli degli altri elementi che prenderemo in considerazione da qui in avanti.
Si tratta infatti di elementi presenti a livello terrestre e marino (non in atmosfera) in forme inorganiche.
L’intervento dei microorganismi trasforma le forme inorganiche in forme organiche che entrano nella catena alimentare.
Gli organismi viventi con le loro spoglie o gli escrementi restituiscono l’elemento al terreno dove può subire processi di rimineralizzazione.
IL POTASSIO
pur non partecipando alla formazione di particolari composti organici, trovandosi nella cellula come ione libero, il potassio assorbito delle piante talvolta eguaglia il quantitativo dell’azoto.
Le funzioni del potassio nelle piante sono probabilmente superiori a quelle finora riconosciute tra le quali citiamo:
· bilancio idrico
· sviluppo di tessuti meristematici
· metabolismo dei carboidrati
Il problema del potassio non è da attribuire alla usa carenza quantitativa, ma alla sua scarsa presenza in forme assimilabili dalle piante (nei terreni agrari lo troviamo in quantità di circa del 1,5%)
Il potassio è infatti presente in minerali primari (feldspati e miche) in grosse quantità, ma essendo partecipe della struttura cristallina non è disponibile per le piante.
Circa il 5% del potassio è invece presente tre i pacchetti strutturali di minerali argillosi (vermiculiti) restando così fissato in forma non scambiabile, ma disponibile solo in tempi lunghi.
Solo l’1-2% del potassio totale è presente nel complesso di scambio e quindi realmente assimilabile.
Nei terreni agricoli la successione delle culture esaurisce facilmente il potassio disponibile e per questo motivo occorre l’impiego dei fertilizzanti o introdurre dei tempi di riposo del terreno.
LO ZOLFO
Lo zolfo viene considerato un elemento secondario in quanto difficilmente si manifestano problemi legati alla sua carenza.
E’ presenti in amminoacidi, coenzimi e vitamine. Alcune piante (le crucifere) contengono glucosidi solforati, altre composti solforati fondamentali per il loro aroma (vedi aglio e cipolla).
Lo zolfo è presente in diversi minerali in particolare solfati e pirite (solfuro).
Le piante lo assimilano come ione solfato mediante meccanismi di trasporto attivo.
Un importante ruolo viene giocato nei terreni dai tiobatteri (chiemioautotrofi) che traggono l’energia per il loro sviluppo dalla ossidazione dello zolfo a acido solforico, arrivando a contribuire all’acidificazione del terreno.
IL CALCIO
Anche il calcio viene considerato un elemento secondario, è molto diffuso nei vegetali con importanti funzioni legate alla resistenza meccanica dei tessuti.
Il calcio, come abbiamo visto, è inoltre molto importante per le caratteristiche chimico fisiche del suolo.
Nei terreni è presente soprattutto sottoforma di carbonati, solfati e silicati e possiamo distinguere un calcare attivo ed un calcare inerte.
Calcare inerte = carbonato di calcio in granuli grossi che non si scioglie facilmente
Calcare attivo = carbonato di calcio che si scioglie facilmente entrando nel complesso di scambio.
IL MAGNESIO
Completiamo con il magnesio l’elenco degli elementi secondari.
L’importanza del magnesio è soprattutto legata alla formazione della clorofilla, ma questo elemento gioca importanti ruoli come cooenzima in numerose vie metaboliche.
Nel terreno si trova in genere in forme analoghe a quelle del calcio.
MICROELEMENTI
Le funzioni dei microelementi sono per lo più legate alla loro partecipazione in complessi enzimatici (vedi esempio nitrogenasi) che coinvolgono diverse vie metaboliche.
Il ferro, rame, manganese e zinco vengono assimilati in forma cationica, mentre il boro e il molibdeno in forma anionica (rispettivamente come borato e molibdato).
Molti di questi microelementi possono diventare addirittura tossici se ne aumentiamo la concentrazione ionica.