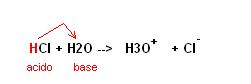Il prodotto ionico dell’acqua
L’acqua distillata ha una bassa conducibilità elettrica dovuta alla sua parziale dissociazione secondo il seguente equilibrio:
2H2O ↔ H3O++ OH– (i)
sebbene lo ione H3O+sia quello realmente presente in soluzione in molti testi lo stesso equilibrio viene ancora espresso come:
H2O ↔ H++ OH– (ii)
ai fini pratici gli equilibri (i) e (ii) sono del tutto analoghi.
Poichè la corrente elettrica che attraversa una soluzione è tanto maggiore quanto più specie ioniche sono in essa disciolte, possiamo sperimentalmente misurare quanta corrente attraversa un certo volume di acqua distillata e da questo valore ricavare quanti ioni H++OH– si sono liberati (dissociati).
Se eseguissimo questa misura troveremmo che circa ogni 55 moli di acqua le moli di H+ che si formano sono circa 0,00000001.
La Keq dell’equilibrio (ii) può essere espressa in questo modo:
Ke = [H+][OH–]/[H2O]
Se supponiamo di partire da una [H2O] = 55 moli/l all’equilibrio la concentrazione di acqua che si otterrebbe sarebbe quella iniziale (55 moli/l) meno la parte che si è dissociata formando H++OH–.
In pratica la concentrazione di H2O all’equilibrio diventerebbe:
55 – 0,00000001 = circa 55
in altre parole possiamo dire che la concentrazione dell’acqua non è cambiata e che è quindi rimasta costante.
Possiamo inglobare il valore della concentrazione dell’acqua nella costante Ke trovando una nuova costante denominata Kw (w= water) o costante di dissociazione dell’acqua.
Kw = [H+][OH–] = 10-14 (iii)
la relazione (iii) prende anche il nome di prodotto ionico dell’acqua
Le teorie sugli acidi
Nella nostra esperienza personale pur non conoscendo nulla della chimica utilizziamo spesso il termine di sostanza acida.
Il gusto acido è infatti uno dei gusti percepiti dalla nostra lingua e siamo per tanto in grado di affermare quali siano alcuni alimenti acidi o meno.
Dal punto di vista chimico la definizione di sostanza acida è stata più travagliata, attualmente coesistono tre definizioni principali di sostanza acida che trovano diverse applicazioni.
Le tre teorie sono quelle di:
- Arrhenius (1877)
- Bronsted-Lowry (1923)
- Lewis (1923)
TEORIA DI ARRHENIUS
“un acido è una sostanza che in soluzione acquosa libera degli ioni H+, una base è una sostanza che in soluzione acquosa libera ioni OH-“
Si tratta della teoria più semplice, ma come vedremo ha dei forti limiti.
Secondo questa teoria l’acido cloridrico HCl è una specie acida perchè in acqua si dissocia liberando ioni H+ secondo la seguente reazione:
HCl → H+ + Cl–
mentre l’idrossido di sodio è una base perchè in acqua si dissocia liberando ioni OH– secondo la seguente reazione:
NaOH → Na+ + OH–
Vediamo alcuni limiti di questa teoria
- si parla solo di soluzioni acquose, mentre possono esistere degli acidi anche in solventi diversi dall’acqua
- come abbiamo detto in realtà non esiste lo ione H+, ma lo ione H3O+
- Non possiamo spiegare il comportamento acido o basico di alcune sostanze, ad esempio l’ammoniaca (NH3) è basica, ma non contiene nella sua molecola nessun gruppo OH che possa essere liberato
TEORIA DI BRONSTED-LOWRY
“un acido è una sostanza in grado di cedere un protone ad un’altra sostanza chiamata base”
Questa teoria ovvia ai difetti della teoria precedente ed introduce alcune interessanti considerazioni.
- un acido non esiste in quanto tale, ma solo in presenza di una base
- una sostanza può comportarsi da acido o da base a seconda della specie chimica con cui viene fatta reagire
Chiariamo subito che la specie chimica H+ può essere assimilata ad un protone, nel senso che trasferire un H+ da una sostanza ad un’altra è equivalente al trasferimento di un protone.
Vediamo allora perchè secondo questa teoria l’acido cloridrico è un acido:
Quando mettiamo dell’HCl in acqua avviene la seguente reazione:
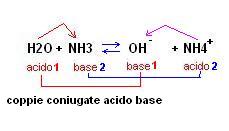
Questa teoria ci spiega anche perchè l’ammoniaca in acqua si comporta da base (cosa che non riusciva a fare la teoria di Arrhenius)
Come si può notare la stessa specie chimica, ossia l’acqua, si comporta da base se messa a contatto con una sostanza che ha maggiore tendenza a cedere protoni (HCl) , mentre si comporta da acido se messa a contatto con una sostanza che ha maggiore tendenza ad acquistare protoni (ammoniaca).
L’esistenza di una sostanza acida è connessa quindi dalla esistenza di una sostanza basica che è in grado di accettare il protone perso dalla specie acida stessa.
La teoria di Bronsted-Lowry ha anche un’altra conseguenza indiretta.
Nella unità didattica precedente abbiamo parlato di equilibri chimici.
Anche una specie acida o basica può dar luogo ad un equilibrio.
Ad esempio:
Se la reazione è in equilibrio dobbiamo pensare che avvenga anche la reazione inversa ossia:
OH– + NH4+
Tra queste due specie chimiche la seconda cede un protone alla prima per cui la specie NH4+ si comporta da acido, mentre la specie OH– da base.
Se questa reazione inversa non avvenisse l’equilibrio non ci sarebbe e potremmo dire che la reazione è completamente spostata verso destra.
La teoria di Bronsted-Lowry ci dice quindi che in un equilibrio acido base esistono due coppie di acido base coniugate.
TEORIA DI LEWIS
Questa teoria trova impieghi soprattutto nella chimica organica.
Per Lewis una base è una sostanza in grado di cedere un doppietto elettronico, mentre un acido è una sostanza in grado di accettare un doppietto elettronico.
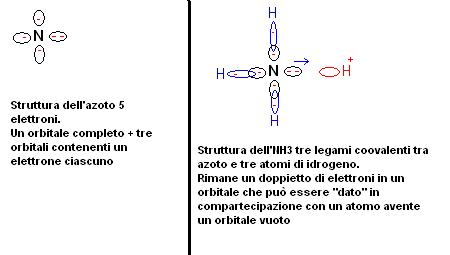
Un atomo di idrogeno contiene un orbitale con un unico elettrone.
Quando un atomo di idrogeno perde un elettrone trasformandosi in ione H+ si trova ad avere un orbitale vuoto.
Alcune molecole come ad esempi quella dell’ammoniaca si trova ad avere un orbitale di valenza contenente due elettroni.
L’azoto è infatti del quinto gruppo e per tanto ha 5 elettroni di valenza nell’ultimo livello energetico.
L’ultimo livello energetico contiene 4 orbitali principali e per tanto nell’azoto troviamo tre orbitali con ciascuno un elettrone ed un orbitale pieno con due elettroni.
L’azoto può quindi dare tre legami coovalenti e rimanere con un doppietto di elettroni in uno dei suoi orbitali.
L’azoto ha quindi un orbitale pieno, mentre lo ione H+ lo ha vuoto.
L’ammoniaca è quindi una base di Lewis perchè ha la possibilità di cedere un doppietto di elettroni, mentre lo ione H+ è un acido perchè ha la possibilità di acquistarlo.
La teoria di Lewis trova applicazione nella chimica organica in quanto riesce a spiegare il comportamento acido o basico di sostanze che risulterebbe invece difficile con le altre teorie.
La scala del pH
Abbiamo visto come il prodotto ionico dell’acqua sia:
Kw = [H+][OH–] = 10-14
Ne deduciamo che se in una soluzione [H+] = [OH–] avremo
[H+] = [OH–] = √10-14 = 10-7
In questa condizione l’ambiente non è acido e neppure alcalino, questa condizione si definisce per tanto neutra.
Supponiamo ora che sia la specie [H+] a prevalere rispetto a quella [OH–], immaginiamo ad esempio che:
[H+]= 0,000001= 10 -6 in questo caso avremo
[OH–]= 0,00000001 = 10 -8 [H+] > [OH–]
Se fossero invece gli [OH–] a prevalere, ambiente basico, ad esempio supponendo:
[OH–]= 0,000001= 10 -6 in questo caso avremo
[H+]= 0,00000001 = 10 -8 [H+] < [OH–]
Concentrazioni di H+ > 10-7 (ricordarsi che 10 -6 > 10-7 ) indicano quindi ambiente acido, mentre concentrazioni di H+ < 10-7 (ricordarsi che 10 -8 < 10-7 ) indicano ambiente basico.
Utilizzare dei valori decimali non è molto comodo, si preferisce pertanto esprimere l’acidità di una soluzione utilizzando un particolare termine matematico ossia il logaritmo decimale.
Il logaritmo decimale rappresenta l’esponente che elevato alla base 10 da il numero richiesto.
Ad esempio:
Log10 106= 6 (da qui in avanti scrivendo semplicemente Log, intendendo il logaritmo decimale)
Si può usare la calcolatrice scientifica di window per calcolare i logaritmo di qualsiasi numero (per la calcolatrice scientifica start/tutti i programmi/ accessori /calcolatrice / visualizza / scientifica).
Ad esempio provate a calcolare il
Log 0,5643 ( R = -0,248)
Se abbiamo quindi una concentrazione di H+ pari a 10 -6 (ambiente acido) avremo
Log 10 -6 = -6
Al fine di evitare il segno negativo viene introdotto il termine di pH
pH = – Log [H+] nell’esempio appena fatto avremo
pH = – Log 10 -6 = 6
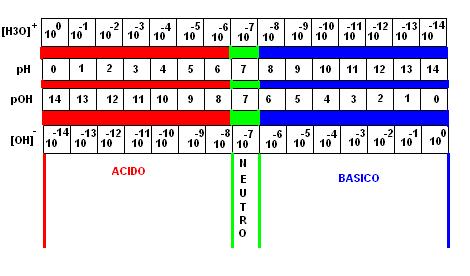
Quando l’ambiente è neutro il pH = 7 ([H+] = [OH–] = 10-7 )
L’ambiente è acido per valori minori di 7, mentre è basico per valori superiori.
Poiché la Kw = 10 -14 in pratica la scala del pH può assumere valori da 0 a 14.
Esiste una scala analoga a quella del pH che è legata alla concentrazione degli OH– invece degli H+, questa scala prende il nome di pOH.
La relazione tra pH e pOH è la seguente:
pH + pOH = 14 (infatti [H+][OH–] = 10-14 )
pertanto se il pH = 6 il pOH = 8
La tabella sottostante riporta le relazioni
tra le concentrazioni di ioni H+ OH– pOH e pH
La forza degli acidi e delle basi.
Abbiamo visto come il concetto di Bronsted-Lowry di acido o base sia relativo.
Una stessa specie chimica può comportarsi da acido o da base a seconda di quale sostanza reagisca con essa.
Possiamo immaginare che un acido sia tanto più forte quanto sia in grado di cedere protoni ad una maggiore gamma di sostanze (discorso inverso per una base), ma come possiamo valutare numericamente la forza di un acido?.
Consideriamo un generico acido HA, se lo mettiamo in acqua avremo il seguente equilibrio:
HA + H2O ↔ A– + H3O+
che presenterà la seguente costante di equilibrio
Ke = [A–][H3O+]/ [HA] [H2O]
Se siamo in una soluzione acquosa la concentrazione di H2O sarà talmente alta che quella che possiamo considerare trascurabile la quantità di essa che reagisce con l’acido.
La concentrazione dell’acqua rimane quindi praticamente invariata e la possiamo inglobare nella Ke trovando una nuova costante che chiameremo Ka (Kb per una base)
Ka = [A–][H3O+]/ [HA]
Se il valore della Ka è alto la concentrazione di A– + H3O+ sarà notevole per cui l’equilibrio sarà spostato verso destra, discorso contrario nel caso di bassi valori.
Abbiamo quindi la possibilità di avere una valutazione numerica della forza di un acido attraverso la sua Ka.
Gli acidi forti presentano valori di Ka maggiori di 101 , e possiamo considerarli completamente dissociati, ossia con la reazione di equilibrio completamente spostata verso destra.
Tra gli acidi forti che usiamo più spesso in laboratorio abbiamo:
- Acido cloridrico (HCl)
- Acido solforico (H2SO4)
- Acido nitrico (HNO3)
Gli acidi deboli hanno valori di Ka minori di 10-1, ed in questo caso dobbiamo considerarli solo parzialmente dissociati, ossia dobbiamo prendere in considerazione anche la reazione inversa dell’equilibrio.
Quasi tutti gli acidi “biologici” (citrico, ascorbico, malico etc) sono acidi deboli, in laboratorio l’acido debole che useremo più di frequente è l’acido acetico (CH3COOH) che ha una Ka= 1,8 10-5
Per quanto riguarda le basi, sono forti l’idrossido di sodio (NaOH), l’idrossido di potassio (KOH) e quasi tutti gli idrossidi degli elementi del primo e secondo gruppo, tra le basi deboli più frequentemente usate troviamo l’ammoniaca (NH3).
Torniamo al nostro acido generico HA, abbiamo visto come per Bronsted-Lowry esista sempre una coppia coniugata acido base, nel nostro esempio consideriamo la coppia HA/A–
HA + H2O ↔ A– + H3O+
acido1 base2 base1 acido2
Abbiamo detto come la Ka dell’HA sia Ka = [A–][H3O+]/ [HA]
Ora supponiamo di voler vedere quanto sia forte la base1 A– misurando la sua tendenza a prendere dei protoni dall’acqua
A– + H2O ↔ HA + OH–
La Kb di questo equilibrio (forza della base coniugata a HA) sarà
Kb= [HA] [OH–]/[A–]
Moltiplichiamo il numeratore ed il denominatore della Kb per [H3O+] avremo:
Kb= [HA] [OH–] [H3O+] /[A–] [H3O+]
Ma [OH–] [H3O+] = Kw (prodotto ionico dell’acqua) = 10-14
quindi :
Kb= [HA] Kw /[A–] [H3O+]
Ma [HA] /[A–] [H3O+] = 1/Ka
Per cui Kb = Kw/Ka ed in sintesi
Ka x Kb = Kw
Il prodotto della Ka per la Kb di una coppia acido base coniugata è uguale a 10-14
Supponiamo ora di avere un acido forte con (ad esempio) Ka = 104 quanto sarà forte la sua base coniugata
Kb = Kw/Ka = 10-14/104 = 10-18 (valore inferiore alla Kw)
Se invece abbiamo un acido debole con (ad esempio) Ka = 10-5 la sua base coniugata varrà:
Kb = Kw/Ka = 10-14/10-5 = 10-9 (valore inferiore alla Ka ma superiore alla Kw).
Ne deduciamo che tanto più forte è un acido tanto è più debole la sua base coniugata, la base coniugata agli acidi forti avendo un valore inferiore alla Kw non è in grado di influenzare il pH delle soluzioni acquose, mentre la base coniugata ad un acido debole, pur avendo un valore inferiore a quello della Ka dell’acido ha ancora un valore di Kb superiore al prodotto ionico dell’acqua ed è quindi in grado di influenzare il pH.
Riprenderemo questo concetto quando parleremo dell’idrolisi e dei tamponi.
Determinazione del pH per acidi e basi forti
Vediamo ora di risolvere dei problemi inerenti la determinazione del pH per acidi e basi forti.
Iniziamo nel caso della determinazione del pH per un acido forte, ad esempio l’acido cloridrico (HCl).
Consideriamo la reazione:
HCl + H2O → H3O+ + Cl–
Consideriamo le specie chimiche presenti (escludendo l’acqua) ed indichiamo con C°a la concentrazione iniziale dell’acido.
Dovremo prendere in considerazione un istante iniziale (in cui l’acido non ha ancora trasferito i suoi protoni) ed un istante finale in cui si è raggiunta la condizione di equilibrio.
La situazione che avremo sarà la seguente:
|
SPECIE CHIMICHE |
CONCENTRAZ. INIZIALE |
CONCENTRAZ. EQUILIBRIO |
|
HCl |
C°a |
C°a-X |
|
H3O+ |
0 |
X |
|
Cl– |
0 |
X |
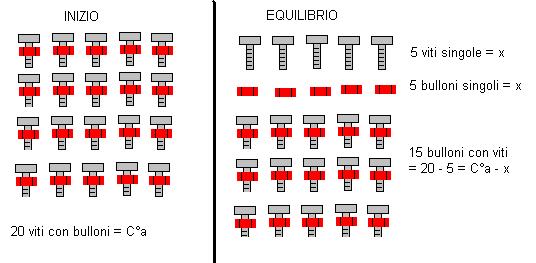
Spiegazione supponiamo di avere in un magazzino un certo numero di viti con dei bulloni attaccati (molecole di HCl indissociate), dopo un certo periodo vengono svitati “x” bulloni.
In quell’istante il numero di bulloni liberi sarà “x” , anche il numero di viti singole sarà “x”, mentre il numero di bulloni con viti sarà il valore iniziale – x.
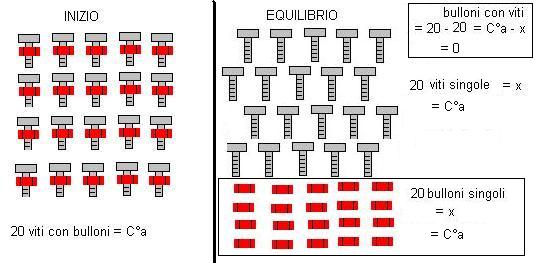
Se l’acido è forte, l’equilibrio è completamente spostato verso destra per cui tutte le molecole di acido si dissociano (si svitano tutte i bulloni dalle viti).
Il valore di x sarà quindi uguale a C°a.
Avremo quindi:
|
SPECIE CHIMICHE |
CONCENTRAZ. EQUILIBRIO |
|
HCl |
C°a – x = 0 |
|
H3O+ |
x = C°a |
|
Cl– |
x = C°a |
La specie chimica che ci interessa ai fini del pH sono gli H3O+ , possiamo quindi dire nel caso di un acido forte che:
pH = -log [H3O+] = -log C°a
E’ sufficiente quindi conoscere la concentrazione in moli/l (Molarità = M) iniziale dell’acido forte per determinarne il pH.
Ad esempio: determinare il pH di una soluzione contenente HCl 0,3 M
Svolgimento:
pH = -log [H3O+] = -log C°a = -log 0,3 = 0,5
Nel caso di una base forte il discorso è identico solo che la concentrazione di riferimento diventa quella iniziale della base (C°b), e dalla formula analoga si ottiene il pOH anziché il pH
pOH = -log[OH–] = -log C°b quindi pH = 14 – pOH
E’ sufficiente quindi conoscere la concentrazione in moli/l (Molarità = M) iniziale della base forte per determinarne il pH.
Ad esempio: determinare il pH di una soluzione contenente NaOH 0,04 M
Svolgimento
pOH = -log[OH–] = -log C°b = -log 0,04 = 1,4
per ricavare il pH dovremo fare pH = 14 – pOH = 14 – 1,4 = 12,6
Determinazione del pH per acidi e basi deboli.
Se abbiamo a che fare con un acido debole non tutte le molecole di acido risulteranno all’equilibrio dissociate, anzi, in genere nel caso degli acidi deboli solo una piccolissima parte di esse libera ioni H3O+ .
Potremo pensare di avere una grande massa iniziale di viti con bulloni e di svitarne all’equilibrio solo una piccolissima parte di essi.
L’entità della dissociazione (quindi la forza) dell’acido è connessa al valore della Ka.
Facciamo un caso pratico considerando dell’acido acetico.
CH3COOH + H2O ↔ CH3COO– + H3O+
Concentrazione iniziale acido acetico = C°a
Ka = [CH3COO– ] [H3O+ ]/[CH3COOH ] = 1,8 x 10 -5
Anche in questo caso potremo costruire la seguente tabella:
|
SPECIE CHIMICHE |
CONCENTRAZ. INIZIALE |
CONCENTRAZ. EQUILIBRIO |
|
CH3COOH |
C°a |
C°a-X |
|
H3O+ |
0 |
X |
|
CH3COO– |
0 |
X |
In questo caso però “x” non è uguale a C°a, come nel caso degli acidi forti, ma presenta un valore in genere molto minore a quello di C°a.
Possiamo sostituire i termini “x” e “C°a-X ” nella espressione della costante di dissociazione Ka ed avremo
Ka = x * x /C°a-X = x2/C°a-X
Si tratta di una equazione di secondo grado che può essere facilmente risolta se immaginiamo che le molecole di acido che si dissociano (X) siamo in realtà molto poche rispetto a quelle iniziali (C°a).
In questo caso C°a -x ≈ C°a
Con questa semplificazione avremo:
Ka = x2 / C°a
Ricordandoci che x non è altro che la concentrazione degli ioni H3O+ all’equilibrio potremo dire:
Ka = [H3O+ ]2 / C°a
per cui per un acido debole avremo :
[H3O+ ]= √(C°a * Ka)
Nota la concentrazione di [H3O+ ] potremo poi facilmente ricavare il pH.
Facciamo un esempio: Determinare il pH di una soluzione contenente dell’acido acetico 0,01 M (Ka = 1,8 x 10-5)
[H3O+ ]= √(C°a * Ka) = √ (0,01 * 1,8 x 10-5 )= √ 0,00000018 = 4,24 * 10 -4
NB: per semplificare l’equazione di secondo grado avevamo immaginato che C°a fosse molto maggiore di x, ora possiamo stabilirlo infatti:
C°a = 0,01 x= 4,24 * 10 -4 = 0,000424 quindi
0,01 – 0,000424 ≈ 0,01
pH = -log [H3O+] = -log 4,24 * 10 -4 = 3,37
NB: un acido forte della medesima concentrazione avrebbe dato un pH decisamente più basso, infatti applicando la formula di calcolo per gli acidi forti avremmo ottenuto
pH = -log [H3O+] = -log C°a = -log 0,01 = 2 (al posto di 3,37)
Per analogia possiamo determinare la formula di calcolo per le basi deboli ed otteremo:
[ OH–]= √(C°b * Kb)
da questa formula ricaveremo il pOH e quindi il pH.
Esempio determinare il pH di una soluzione 0,65M di NH3 (ammoniaca) avente Kb = 1,8 x 10 -5
Svolgimento:
[ OH–]= √(C°b * Kb) = √(0,65*1,8 x 10 -5 ) = 0,0034
pOH = -log 0,0034 = 2,47
pH = 14 – 2,47 = 11,53
L’idrolisi
Per comprendere il fenomeno dell’idrolisi bisogna avere ben chiaro il concetto acido base di Bronsted-Lowry ed in particolare il discorso che la base coniugata ad un acido forte (o l’acido coniugato ad una base forte) non è in grado di influenzare il pH, mentre la base coniugata ad un acido debole (o l’acido coniugato ad una base debole) è in grado di influenzare il pH di una soluzione acquosa.
Abbiamo visto come la relazione che lega il valore di Ka e Kb di due specie coniugate sia:
Ka x Kb = Kw
Ne deduciamo che tanto è più alto Ka tanto è più basso Kb (e viceversa).
Il fenomeno dell’idrolisi è quel fenomeno per cui dalla dissoluzione (scioglimento) di alcuni tipi di sali in acqua si ottengono modifiche dei valori di pH.
In altre parole:
- ci sono sali che si può prevedere che una volta sciolti in acqua non modificano il pH (es NaCl)
- ci sono sali che si può prevedereche una volta sciolti impartiscono un pH acido (es NH4Cl)
- ci sono sali che si può prevedere che una volta sciolti impartiscono un pH basico (es CH3COONa)
- ci sono sali che non si può prevedere subito come si comportino una volta sciolti in acqua
Caso 1. (acido formato da acido forte e base forte)
Vediamo di comprendere i motivi di questo fenomeno.
Iniziamo a considerare l’esempio di un sale come il cloruro di sodio che non modifica il pH (non da idrolisi)
Per ottenere questo sale noi dobbiamo fare reagire dell’HCl con della NaOH secondo la seguente reazione
HCl + NaOH → NaCl + H2O
Possiamo quindi dire che il cloruro di sodio si ottiene per reazione di un acido (HCl) forte con una base (NaOH) forte.
Una volta sciolto in acqua il cloruro di sodio si dissocia liberando ioni Na+ e ioni Cl–
NaCl → Na+ + Cl–
Vediamo per Bronsted-Lowry che specie chimiche sono gli ioni Na+ e ioni Cl–
Na+ = acido coniugato alla base forte NaOH
Cl–= base coniugato all’acido forte HCl
Poiché entrambe le specie sono coniugate a specie forti non sono in grado di influenzare il pH, per cui il sale NaCl non influenza il pH
Conclusione:
Un sale formato da un acido forte e da una base forte non influenza il pH
Caso 2. (sale formato da acido forte e base debole)
Il discorso cambia quando prendiamo in considerazione un sale formato dalla reazione di una specie forte e una specie debole.
Il NH4Cl ad esempio si ottiene per reazione di HCl (acido forte) con NH3 (base debole)
HCl + NH3 → NH4Cl
Il cloruro di ammonio in acqua si dissocia liberando i seguenti ioni
NH4Cl → NH4++ Cl–
Vediamo per Bronsted-Lowry che specie chimiche sono gli ioni NH4+ e ioni Cl–
NH4+ = acido coniugato alla base debole NH3
Cl–= base coniugato all’acido forte HCl
La specie Cl– , come abbiamo già visto non è in grado di influenzare il pH, mentre la specie NH4+ si comporta come un acido debole avente
Ka = Kw/Kb (con Kb= costante dell’ammoniaca = 1,8 * 10-5)
Ka = 10-14/1,8 * 10-5 = 5,55 *10-10
Vediamo allora cosa succede al pH se sciolgo 4g di NH4Cl in 100 ml di acqua.
Per prima cosa devo stabilire la molarità del sale, per fare questo devo ricavare le moli equivalenti a 4g.
Il peso molecolare del cloruro di ammonio è
- at N = 14 x 1 = 14
- at H = 1 x 4 = 4
- at Cl= 35,5 x 1 = 35,5
——
53,5 = peso di una mole di cloruro di ammonio
n° moli = g / peso molecolare
n° moli = 4 / 53,5 = 0,074 moli in 100 ml di acqua
il numero di moli in un litro sarà quindi 0,0074
(0,074moli : 100ml = xmoli : 1000ml)
Abbiamo quindi una concentrazione di sale pari a 0,0074 moli/litro (M).
Questo sale in acqua si dissocia con la seguente reazione
NH4Cl → NH4++ Cl–
Le moli di NH4+ sono quindi uguali alle moli di NH4Cl.
Anche la concentrazione della specie NH4+ sarà quindi 0,0074 M
Questa specie si comporta come un acido debole con Ka = 5,55 *10-10
La formula da applicare sarà quindi quella relativa al pH degli acidi deboli:
[H3O+ ]= √(C°a * Ka)
dove in questo caso C°a è anche la concentrazione del sale, mentre Ka si trova facento Kw/K base coniugata
Sostituendo alla formula avremo
[H3O+ ]= √(0,0074 * 5,55 *10-10) = 6,44 * 10-6
da cui
pH = -log 6,44 * 10-6 = 5,19
Conclusione:
Un sale formato da un acido forte e da una base debole impartisce un pH acido (si comporta come un acido debole)
Caso 3. (sale formato da base forte e acido debole)
Se abbiamo capito il caso precedente non dovrebbero esserci problemi per comprendere cosa succede in questo caso.
Questo tipo di sali si comporta in effetti come una base debole.
Se ad esempio supponiamo di avere una soluzione 0,04M di acetato di sodio (CH3COONa) sale formato dall’acido debole acetico e dalla base forte idrossido di sodio, dovremmo immaginare di avere a che fare con una base debole avente come concentrazione 0,04M e come Kb il valore ottenuto da Kw/Ka (con Ka valore della costante di dissociazione dell’acido acetico)
La formula che dovremo applicare sarà:
[ OH–]= √(C°b * Kb)
da cui otterremo il pOH e quindi il pH.
Conclusione:
Un sale formato da un acido debole e da una base forte impartisce un pH basico (si comporta come una base debole)
Caso 4. (sale formato da base debole e acido debole)
In questo caso è difficile prevedere a priori come si comporti il sale una volta sciolto in acqua.
In pratica bisogna confrontare i valori delle Ka e della Kb delle due specie coinvolte alla formazione del sale.
Se Ka > Kb il sale impartirà pH acido
Se Kb>Ka il sale impartirà pH basico
Se Kb=Ka il sale non influenzerà il pH
I tamponi
I tamponi sono soluzioni a pH stabile, ossia sono delle soluzioni il cui pH varia di poco sia per aggiunta di acidi, sia per aggiunta di base, sia per diluizione.
Se aggiungiamo all’acqua distillata una goccia di acido o di base potremo notare forti variazioni di pH, l’acqua distillata non è quindi un tampone di pH.
Ci sono invece delle situazioni in cui anche se aggiungiamo, entro certi limiti, quantità di acidi o basi il pH non varia di molto, questi casi sono detti tamponi.
L’esempio più semplice di soluzione tampone è ad esempio una soluzione contenente un acido o una base molto concentrati.
Se a queste soluzioni aggiungiamo delle quantità limitate di acidi o basi il pH varierà di poco o non varierà per niente.
Quando si parla comunemente di soluzioni tamponi ci si riferisce però ad una casistica differente.
Le soluzioni tampone “tipiche” sono quelle in cui sono contemporaneamente presenti un acido debole con la sua base coniugata o una base debole con il suo acido coniugato.
Facciamo degli esempi considerando un acido debole.
Acido debole = acido acetico = CH3COOH
base coniugata all’acido acetico = CH3COO–
Come abbiamo visto nel caso dell’idrolisi la specie CH3COO– in realtà deriva dalla dissociazione di un sale (ad esempio CH3COONa)
Nella pratica possiamo dire che un sistema tampone esiste quando c’è un acido debole con un suo sale ad esempio CH3COOH + CH3COONa
Per analogia possiamo dire che un sistema tampone si ha con la contemporanea presenza di una base debole ed un suo sale ad esempio
NH3 + NH4Cl
Con un piccolo ragionamento possiamo intuire come mai si ottengono dei sistemi tamponi.
Prendiamo ad esempio CH3COOH + CH3COONa
CH3COOH è un acido debole
CH3COONa è un sale che da idrolisi basica (si comporta come una base debole).
Ci troviamo quindi ad avere la contemporanea presenza di un acido e di una base debole.
Se aggiungiamo un acido, questo sarà parzialmente neutralizzato dalla base debole, mentre se aggiungiamo una base questa sarà parzialmente neutralizzata dalla presenza dell’acido debole. In entrambi i casi l’effetto dell’aggiunta dell’agente esterno sarà “tamponato” e i riflessi sul pH della soluzione saranno attutiti.
Vediamo in dettaglio come funzionano i sistemi tamponi e come si possa determinare il pH di questo tipo di soluzioni.
Proviamo a “costruire” un tampone con CH3COOH + CH3COONa mettendo in un litro di soluzione 0,3 moli di acido acetico e 0,5 moli di acetato di sodio.
L’acetato di sodio è un sale completamente solubile per cui si dissocerà completamente in
CH3COONa → CH3COO– + Na+
se partiamo da 0,5 moli di acetato di sodio avremo quindi
0,5 moli di CH3COO–
L’acido acetico è invece un acido debole e per esso varrà il seguente equilibrio
CH3COOH + H2O ↔ CH3COO– + H3O+
Come abbiamo visto in precedenza questo equilibrio è già di per se poco spostato verso destra, se poi viene aggiunto del CH3COO– , proveniente dall’acetato di sodio, il principio di Le Chatellier ci dice che l’equilibrio sarà ancora più spostato verso sinistra.
Potremo quindi asserire con buona approssimazione che all’equilibrio l’acido acetico sarà pochissimo dissociato per cui la concentrazione di CH3COOH sarà ancora quella iniziale, mentre la concentrazione di CH3COO– sarà quella del sale che abbiamo aggiunto.
Cerchiamo di rifare la tabella che abbiamo già visto per questo caso
|
SPECIE CHIMICHE |
CONCENTRAZ. INIZIALE |
CONCENTRAZ. EQUILIBRIO |
|
CH3COOH |
C°a |
C°a- x |
|
H3O+ |
0 |
X |
|
CH3COO– |
C°s |
C°s + x |
Come abbiamo detto le molecole che si dissociano, x, sono pochissime per cui potremo dire che:
C°a- x ≈ C°a = concentrazione iniziale dell’acido = [CH3COOH ]
C°s- x ≈ C°s = concentrazione iniziale del sale = [CH3COO– ]
Vediamo di scrivere la Ka e di sostituire i valori
Ka = [CH3COO– ] [H3O+]/ [CH3COOH]
sostituendo avremo
Ka = C°s * [H3O+]/ C°a
Per cui:
[H3O+] = Ka * C°a / C°s
NB: CH3COO– che abbiamo indicato come specie salina e che quindi abbiamo indicato con “s” non è altro che la base coniugata all’acido debole CH3COOH, l’espressione sopra riportata può quindi essere espressa in maniera più generale come
[H3O+] = Ka * C°a / C°b con C°a e C°b concentrazioni delle specie coniugate
Ma come mai in questo caso il pH diventa stabile?
Facciamo un esempio utilizzando i dati del problema che ricordiamo sono:
0,3 moli di acido acetico e 0,5 moli di acetato di sodio in un litro di soluzione.
Iniziamo a vedere che pH si ottiene sapendo che la Ka = 1,8 10-5
C°a = 0,3 moli/l C°s = 0,5 moli/l
[H3O+] = Ka * C°a / C°s =
1,8 10-5 x 0,3 / 0,5 = 0,0000108
pH = -log 0,0000108 = 4,97
Vediamo cosa succede ora se:
- a) diluiamo
- b) aggiungiamo 0,1 mole di HCl (aggiunta di un acido forte)
- c) aggiungiamo 0,1 mole di NaOH (aggiunta di una base forte)
(a) diluizione
Supponiamo di portare il volume da un litro a due litri
sia C°a che C°s si dimezzano
C°a = 0,15
C°s = 0,25
il rapporto tra C°a e C°s però non cambia
0,3 / 0,5 = 0,15/0,25
di conseguenza avremo
1,8 10-5 x 0,15 / 0,25 = 0,0000108
pH = -log 0,0000108 = 4,97
Il pH nonostante la diluizione non è cambiato
(b) aggiunta di un acido forte
Abbiamo supposto di aggiungere 0,1 mole di HCl.
Nella soluzione abbiamo due sostanze, un acido debole ed una sua base coniugata.
Di queste due sostanze ovviamente sarà la base coniugata a reagire con l’acido
CH3COO– + HCl -> CH3COOH + Cl–
In pratica CH3COO– reagisce con HCl e si forma CH3COOH, quindi:
C°s diminuisce di 0,1 mole (acido aggiunto) = 0,5 moli – 0,1 moli = 0,4 moli
C°a aumenta di 0,1 mole (acido aggiunto) = 0,3 moli + 0,1 mole = 0,4 moli
riapplichiamo la solita formula con i nuovi valori
[H3O+] = Ka * C°a / C°s =
1,8 10-5 x 0,4 / 0,4 = 1,8 10-5
pH = -log 1,8 10-5= 4,74
il pH è cambiato da 4,97 a 4,74 (0,25 unità) un valore molto basso se pensiamo che 0,1 moli litro di HCl danno un pH = 1 (molto più basso di 4,74)
(C) aggiunta di una base forte
Abbiamo supposto di aggiungere 0,1 mole di NaOH.
In questo caso sarà l’acido debole a reagire secondo la seguente reazione:
CH3COOH + NaOH → CH3COO– + Na+ + H2O
In pratica CH3COOH reagisce con NaOH e si forma CH3COO–, quindi:
C°s aumenta di 0,1 mole (base aggiunta) = 0,5 moli + 0,1 moli = 0,6 moli
C°a diminuisce di 0,1 mole (base aggiunta) = 0,3 moli – 0,1 mole = 0,2 moli
riapplichiamo la solita formula con i nuovi valori
[H3O+] = Ka * C°a / C°s =
1,8 10-5 x 0,2 / 0,6 = 0,000006
pH = -log 0,000006 = 5,22
il pH è cambiato da 4,97 a 5,22 (0,25 unità) un valore molto basso se pensiamo che 0,1 moli litro di NaOH danno un pH = 13 (molto più alto di 5,22)
Le Titolazioni
Come titolazione intendiamo un particolare tipo di analisi chimica quantitativa basata sulla misurazione di volumi di liquidi (analisi volumetrica).
Una analisi quantitativa è una analisi che porta come risultato ad ottenere dei valori numerici, ad esempio quanto ferro è contenuto in un metallo in % o quanti globuli rossi ci sono nel sangue.
Le analisi quantitative si differenziano da quelle qualitative che invece determinano la presenza o l’assenza di una qualche sostanza (ad esempio una analisi del sangue che ricerca la presenza di un qualche batterio senza determinarne la quantità).
Il meccanismo base delle titolazioni è relativamente semplice, si prendono due sostanze che reagiscono tra di loro, ad esempio il caso più frequente è di un acido con una base.
Supponiamo di avere quindi dell’acido cloridrico e dell’idrossido di sodio.
Immaginiamo ora di conoscere la concentrazione dell’acido (ad esempio 0,1 M) e di volere determinare la concentrazione della base.
Scriviamo la reazione chimica
HCl + NaOH → NaCl + H2O
Da questa reazione notiamo che una mole di acido viene neutralizzata da una mole di base (rapporto 1:1) per dare del cloruro di sodio e dell’acqua.
Poichè il cloruro di sodio è formato da un acido forte e da una base forte non darà idrolisi, per cui nel momento in cui le moli di acido neutralizzano esattamente le moli di base il pH sarà perfettamente neutro.
Se quindi prendiamo un certo volume di acido ed aggiungiamo piano piano della base avremo:
- quando le moli di acido sono di più di quelle della base un pH acido
- quando le moli di acido sono uguali a quelle della base un pH neutro
- quando le moli di base sono in eccesso rispetto a quelle dell’acido un pH basico
Ne consegue che se riuscissimo a fermarci esattamente a pH neutro note le moli di base aggiunta potremo calcolare (visto il rapporto 1:1) anche le moli di acido.
Supponiamo allora di avere preso 20 ml di HCl 0,1 M e di avere consumato per raggiungere l’equivalenza (numero moli acido = numero moli di base ossia pH = 7) 15,3 moli di NaOH avente concentrazione sconosciuta.
Vediamo che calcoli dobbiamo operare:
M = molarità = moli/Volume (litri) da cui
moli = M . V(litri)
dati : M HCl = 0,1 V HCl = 20 ml = 0,02 l
M NaOH = x V NaOH = 15,3 ml = 0,015 l
moli HCl = 0,1 * 0,02 = 0,002
all’equivalenza 0,002 saranno anche le moli di NaOH per cui
0,002 = M NaOH * 0,015 da cui M = 0,002 / 0,015 = 0,13 moli/l
In pratica quando il rapporto di reazione è 1:1 possiamo dire che
Macido * V (litri acido) = Mbase * V(litri base)
Rimane da risolvere un problema:
La soluzione di acido cloridrico è trasparente, la soluzione di idrossido di sodio è trasparente, la soluzione di cloruro di sodio è acqua è ancora trasparente, quindi ad occhio non possiamo capire quando le moli di acido sono uguali alle moli di base.
Per visionare il punto di equivalenza (moli acido = moli base) dobbiamo ricorrere all’uso di particolari sostanze chiamate indicatori.
Queste sostanze hanno colori diversi a seconda che l’ambiente sia acido o basico.
Ad esempio la fenolftaleina è un indicatore che è trasparente in ambiente acido, mentre diventa rosa in ambiente basico.
Se aggiungiamo qualche goccia di indicatore alla nostra soluzione di acido, vedremo in origine che la soluzione acida resta incolore, quando aggiungendo l’idrossido di sodio si formerà una soluzione permanentemente rosa vorrà dire che il pH è diventato basico.
Fermandoci alla prima goccia di idrossido che porta al cambiamento di colore avremo la possibilità di ricavare il volume di base che neutralizza l’acido..
Le titolazioni possono essere fatte anche facendo reagire acidi deboli con basi forti o viceversa.
In questo caso però il sale che si formerà all’equivalenza darà idrolisi per cui il pH non sarà esattamente neutro.
Per questo tipo di titolazioni bisognerà per tanto scegliere degli indicatori che cambiano il colore in relazione ai valori di pH intorno al quale si ha l’equivalenza.
Gli indicatori
Abbiamo visto che per determinare il punto di equivalenza delle titolazioni occorrono degli indicatori.
Gli indicatori sono in pratica degli acidi o delle basi deboli che hanno come caratteristica quella di avere la parte dissociata di colore diverso dalla parte indissociata.
Supponiamo di avere ad esempio un indicatore che sia un generico acido debole di tipo HIn (di colore rosso).
Questo acido sarà in equilibrio con la sua forma dissociata In– (di colore blu) secondo la seguente relazione:
HIn + H2O ↔ H3O+ + In–
La Ka dell’equilibrio sarà
Ka = [H3O+][ In– ]/[ HIn]
perciò [H3O+]= Ka [ HIn]/ [ In– ]
Quando la concentrazione di [ HIn] = [ In– ] l’indicatore non sarà ne rosso ne blu (colore di viraggio) in questa condizione
[H3O+]= Ka
Per valori di [H3O+]>Ka prevarrà la colorazione rossa [ HIn]>[ In– ], mentre
per valori di [H3O+]<Ka prevarrà la colorazione blu [ In– ]>[ HIn].
Conoscendo il valore della Ka dell’indicatore sarà possibile quindi sapere a che pH cambia colore (basta fare pH viraggio = – log ka).