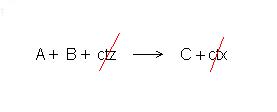Espressione matematica della velocità di reazione
Come cinetica chimica intendiamo lo studio della velocità di una reazione.
Per valutare la velocità di una reazione generica
Reagenti -> Prodotti
Ci possiamo riferire o al tempo di scomparsa dei reagenti oppure al tempo di formazione dei prodotti
Durante una reazione chimica, infatti, i reagenti tendono a scomparire, mentre i prodotti tendono a formarsi.
Per una valutazione quantitativa del fenomeno dobbiamo riferirci alla concentrazione, per cui potremo considerare il decremento della concentrazione dei reagenti in una unità di tempo, oppure l’incremento della concentrazione dei prodotti nella unità di tempo,
Il termine matematico di un decremento o di un incremento è il simbolo greco delta (Δ), per cui:
conc. fin – conc iniz = ΔC, (variazione della concentrazione)
tempo finale – tempo iniziale = Δt (intervallo di tempo)
La velocità della reazione può essere quindi espressa come
- V = – ΔC reagenti/Δt (il segno meno perchè i reagenti diminuiscono)
oppure
- V = ΔC prodotti/Δt
Fattori che influenzano la velocità di una reazione
Diversi sono i fattori che influenzano la velocità della reazione, l’esperienza di laboratorio mette in evidenza come l’aumento della concentrazione, della temperatura e l’eventuale aggiunta di catalizzatori determino variazioni notevoli della cinetica chimica.
I fattori che influenzano la velocità della reazione sono pertanto i seguenti:
- Natura chimica dei reagenti
- Natura fisica dei reagenti
- Concentrazione
- Temperatura
- Presenza di catalizzatori
Possiamo comprendere per quali motivi questi parametri influenzano la velocità delle reazioni attraverso la teoria delle collisioni
Teoria delle collisioni
Consideriamo una generica reazione chimica:
H2 + Cl2 -> 2HCl
Affinché si formi la sostanza HCl occorre che le molecole H2 e Cl2 si incontrino o per meglio dire si scontrino.
Una reazione chimica prevede infatti la rottura di legami e la formazione di nuovi, nel nostro caso ad esempio si dovranno rompere i legami che tengono uniti gli atomi di idrogeno nella molecola H2, si dovranno rompere i legami che tengono uniti gli atomi di cloro nella molecola Cl2 e si dovranno formare i legami tra H e Cl presenti nella molecola di HCl
Poichè ogni molecola è unita da legami generalmente diversi da quelli presenti in un altra molecola possiamo capire come la natura chimica dei reagenti sia un primo fattore che influenza la velocità della reazione.
In pratica possiamo dire che ogni reazione ha dei tempi differenti perchè i legami che entrano in gioco nella trasformazione (che si rompono e si formano) sono differenti da reazione a reazione.
Quando facciamo avvenire una reazione tra un reagente solido ed un reagente liquido o gassoso lo stato fisico può influenzare di molto la velocità.
In un solido infatti le particelle che reagiscono sono quelle presenti nella superficie che è a contatto con l’altro reagente (liquido o gassoso).
Se sminuzziamo il solido a parità di volume complessivo, aumentiamo notevolmente la sua superficie e consentiamo quindi un maggior numero di urti tra i reagenti.
Ritorniamo alle nostre molecole, sulla base di quanto abbiamo asserito possiamo immaginare che se mettiamo in un volume (ad esempio in un becher) una sola molecola di H2 ed una sola molecola di Cl2 le probabilità che esse si incontrino/scontrino sono molto scarse.
Ma se aumentiamo il numero di molecole in una unità di volume, in altre parole la concentrazione, le probabilità degli urti si incrementano notevolmente.
In pratica è lo stesso fenomeno che ci rende plausibile il motivo per cui le probabilità che due auto si urtino siano molto più elevate in una città dove la concentrazione di autovetture è molto alta
Possiamo quindi comprendere il motivo per il quale un aumento della concentrazione determina un aumento della velocità della reazione.
Maggiore è la concentrazione maggiore è la probabilità che due molecole si urtino tra di loro.
Consideriamo nuovamente l’esempio del traffico automobilistico, una macchina che va a forte velocità ha molte più probabilità di fare incidenti rispetto ad un auto che procede a velocità moderata.
La temperatura è legata alla energia cinetica delle molecole.
In pratica un aumento della temperatura determina una maggiore velocità delle particelle e quindi una maggiore probabilità di urti tra di esse.
In realtà, la temperatura ha anche un altro effetto, maggiore energia cinetica significa anche maggiore energia negli urti, e quindi maggiore probabilità di rottura dei legami.
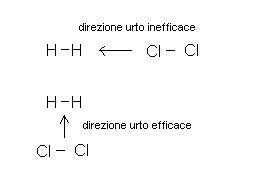
Dobbiamo, infatti dire che non è sufficiente che due particelle si urtino perchè la reazione avvenga.
Le particelle devono, infatti urtarsi con forza sufficiente ed in una determinata posizione
Si parla perciò di URTI UTILI, intendendo come tali gli urti che portano realmente alla formazione dei prodotti di reazione.
La temperatura determina quindi un aumento della velocità di reazione non solo perchè rende più probabili gli urti tra particelle che si muovono a maggiore velocità, ma anche perchè facendo avvenire gli urti con una maggiore energia aumenta la frazione degli urti utili
Abbiamo ora tutte le basi per capire il ruolo dei catalizzatori nella cinetica chimica, ma per farlo dobbiamo comprendere quale sia l’andamento energetico di una reazione.
Possiamo attribuire sia ai reagenti che ai prodotti di una reazione un valore energetico, legato, ad esempio, al contenuto di energia dei legami presenti.
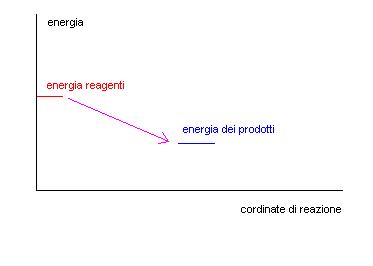
Se abbiamo un grafico in cui nelle ordinate mettiamo l’energia e nelle ascisse il procedere della reazione potremo trovare una situazione di questo tipo:
Questo grafico lascerebbe intendere che i reagenti si trasformino spontaneamente ed istantaneamente in prodotti, come se ci fosse una biglia che scende lungo la linea viola tra un livello più alto ed uno più basso.
In realtà noi sappiamo che le cose non funzionano così, quasi sempre per far avvenire una reazione occorre fornire dell’energia.
Ad esempio per accendere un fiammifero occorre sfregarlo dopo di che la reazione procede spontaneamente e velocemente.
Come possiamo rappresentare graficamente questo fenomeno?.
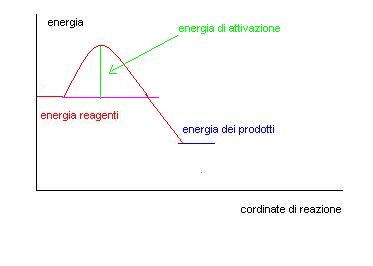
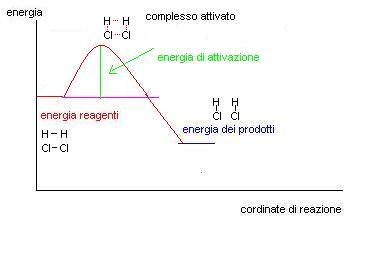
Come si vede dal grafico per far avvenire la reazione bisogna fornire inizialmente una quantità di energia chiamata ENERGIA DI ATTIVAZIONE.
Dopo di che la reazione può procedere da sola.
Quello che si pensa che avvenga in pratica è una situazione analoga alla seguente, riprendiamo la nostra reazione di esempio
H2 + Cl2 -> 2HCl
dobbiamo pensare che questa reazione non avvenga in un solo passaggio ma almeno in due fasi
1^ fase: H2 e Cl2 si urtano è danno luogo ad un composto instabile chiamato complesso attivato, l’energia necessaria per formare questo composto è pari alla energia di attivazione.
2^fase il complesso attivato si decompone e origina le due molecole di HCl
Il superamento di una soglia di energia affinché una reazione avvenga rende ancora più facile comprendere il ruolo del calore che aumentando l’energia cinetica delle molecole rende più facile il superamento dell’energia di attivazione.
Vediamo ora che cosa è un catalizzatore.
Un catalizzatore è una sostanza che pur non entrando nella equazione della reazione ne può aumentare di molto la velocità.
Per ottenere questo effetto il catalizzatore modifica il meccanismo della reazione stessa facendola ad esempio avvenire in più passaggi ma che presentano soglie di energia di attivazione minori rispetto a quelle presenti nella reazione non catalizzata.
Potremmo immaginare una reazione non catalizzata come un tragitto tra due località tra le quali troviamo un impervio passo alpino.
Un ciclista potrebbe non riuscire a superare il passo ed optare magari per un percorso che sebbene più lungo aggiri il colle.
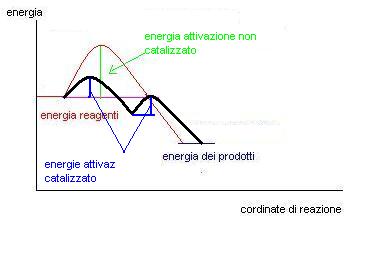
Ecco ad esempio il grafico di una reazione catalizzata rispetto ad una non catalizzata.
Come si può osservare nell’esempio il processo catalizzato avviene in due passaggi, avremo quindi due energie di attivazione, ma prese singolarmente queste energie sono sempre inferiori a quelle del processo non catalizzato.
Lo schema di una reazione generica A + B -> C catalizzata può essere questo:
A + ctz -> A-ctz (formazione di un composto tra A ed il catalizzatore)
A-ctz + B -> C + ctz (reazione tra il composto A-ctz e B con formazione di C9
se tiriamo le somme osserviamo che il catalizzatore partecipa al meccanismo di reazione ma non appare nella equazione della reazione, esso infatti è presente sia come reagente che come prodotto.
Possiamo pensare anche che esistano delle sostanze che anziché ridurre l’energia di attivazione l’aumentino.
Questi catalizzatori negativi prendono il nome di INIBITORI e risultano utili qualora si vogliano rallentare delle reazioni indesiderate.
La legge cinetica
Se analizziamo la teoria degli urti con spirito critico possiamo farci sorgere un dubbio.
Supponiamo di avere una reazione come la seguente:
2 KMnO4 + 2 H2SO4 + 5 H2O2 -> 2MnSO4 + K2SO4 +14 H2O
Quante probabilità ci sono che nello stesso istante due molecole di KMnO4 si urtino con due molecole di H2SO4 e con cinque molecole di H2O2 ?
La risposta ovviamente è che le probabilità che questo avvenga sono praticamente nulle.
Possiamo perciò immaginare che la reazione avvenga in più passaggi, in pratica quindi una molecola ne urta un’altra, il risultato di questa reazione si va a scontrare con un altra particella e così via.
Se però una reazione avviene in più stadi ognuno di essi avrà la sua energia di attivazione è quindi una sua velocità.
Quando in una reazione a più stadi un passaggio è molto più lento degli altri la velocità dell’intero processo dipenderà da questo punto critico.
Ritorniamo ad una reazione generica:
A + B -> C (1)
In base alla teoria degli urti ci aspetteremmo di trovare che la velocità della reazione è proporzionale alle concentrazioni di A e di B.
In termini matematici una relazione di proporzionalità diretta può essere espressa come:
V = K [A] [B] dove [ ] significa concentrazione
una espressione di questo tipo identifica una legge cinetica ossia in che modo varia la velocità di una reazione in funzione della concentrazione.
La legge cinetica non può essere stabilita a priori e deve essere sempre verificata sperimentalmente.
Per la reazione (1) potremmo infatti trovare una relazione di questo tipo
V = K [A]2
ossia sperimentalmente osservare che anche aggiungendo B la velocità non cambia.
Come è possibile questo fatto?
Abbiamo detto che la reazione può avvenire in più stadi, per la reazione (1) possiamo quindi immaginare due possibilità
- meccanismo 1
urto diretto tra A e B con formazione di C
- meccanismo 2
reazione in due passaggi
1) A si scontra con altra molecola di A e forma composto intermedio X
2) x si scontra con B e forma C
Se supponiamo che nel meccanismo 2 sia il primo passaggio quello cineticamente limitante possiamo osservare come in esso non partecipi la specie B.
Ecco quindi che la legge cinetica trovata sperimentalmente ci diventa utile per capire attraverso quale meccanismo di reazione avvenga la trasformazione chimica.
Nell’esempio condotto evidentemente il fatto di trovare una legge cinetica
V = K [A] [B] fa propendere per il meccanismo di reazione 1 in cui partecipano entrambe le specie chimiche, mentre una legge cinetica
V = K [A]2 fa propendere per il meccanismo di reazione 2 con il primo passaggio cineticamente limitante
Si definisce ordine di reazione la somma degli esponenti che compaiono nella legge cinetica.
Le due leggi sopra indicate hanno entrambe ordine 2.
Se dovessimo trovare una legge di questo tipo
V = K [A]
l’ordine di reazione sarebbe 1
Difficilmente si trovano reazioni con ordine superiore al secondo, proprio perchè diventa improbabile che nello stesso istante si urtino più di due particelle.
In precedenza avevamo stabilito come la velocità di una reazione non dipendesse solo dalla concentrazione, ma anche da altri fattori (quali temperatura, catalizzatori etc)
Dove compaiono questi fattori nella equazione cinetica ?
La risposta è ovvia, tutti questi parametri entrano nella costante K presente nella equazione.
Possiamo perciò dire che nella legge cinetica la costante dipende dal tipo di reazione (ogni reazione ha il suo valore della costante) , dalla presenza eventuale di catalizzatore ed ha un valore costante a temperatura costante (incrementando la temperatura la K aumenta).