Abbiamo visto come ad una stessa formula chimica elementare possano in realtà corrispondere due o più sostanze diverse.
Ad esempio il 2 metil butano ed il normal pentano hanno entrambi formula C5H12, ma presentano proprietà chimico-fisico differenti.
Vengono definiti ISOMERI due sostanze diverse che presentano però analoga formula elementare.
Esistono diversi tipi di isomeri:
· ISOMERI DI STRUTTURA
· STEREOISOMERI
Isomeri di struttura
Gli isomeri di struttura sono delle sostanze che hanno la stessa formula molecolare, ma diversa formula di struttura.
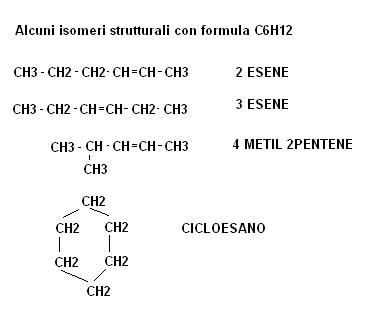
L’esempio fatto all’inizio del capitolo del 2 metil butano e del normal pentano rappresenta un classico esempio di isomeri strutturali.
Gli isomeri di struttura sono in genere sostanze totalmente differenti, sostanze cioè che possono presentare proprietà chimico fisiche assolutamente dissimili.
Vediamo alcuni esempi di isomeri strutturali
Stereoisomeri
Per stereoisomeri si intendono composti che presentano atomi legati nello stesso ordine o sequenza, ma disposti in maniera diversa nello spazio.
Gli steroisomeri hanno in genere proprietà chimiche molto simili (se non uguali), ma presentano sempre qualche proprietà fisica differente.
Due sono i principali tipi di stereoisomeria
1. ISOMERIA GEOMETRICA
2. ISOMERIA OTTICA
ISOMERIA GEOMETRICA
L’isomeria geometrica può interessare composti contenenti un doppio legame (alcheni) o composti ciclici.
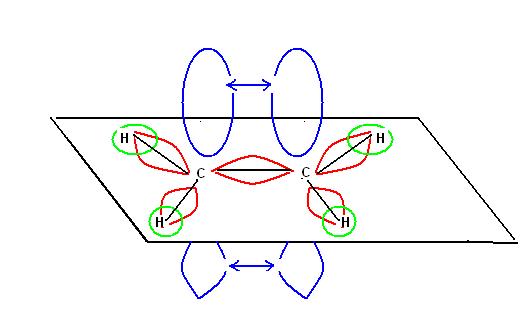
Parlando della ibridizzazione sp2 abbiamo visto come un doppio legame mantenga una struttura planare di questo tipo
I due atomi di carbonio interessati al doppio legame non sono liberi di ruotare l’uno rispetto all’altro.
Conseguenza di questo fatto e che se ai carboni del doppio legame sono legati dei gruppi diversi è possibile che si formino dei particolari tipi di isomeri.
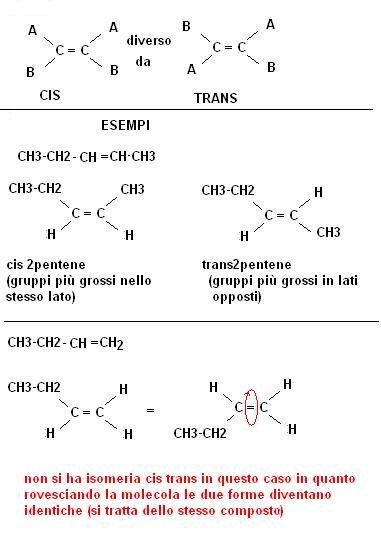
Vediamo l’esempio:
Si ha quindi un isomero cis quando i gruppi più grossi sono attaccati entrambi dalla stessa parte del doppio legame, l’isomero trans quando gli stessi gruppi sono attaccati dai lati opposti.
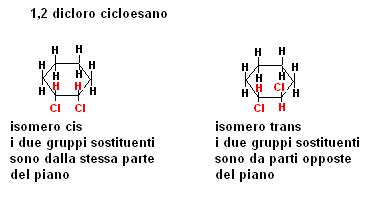
Anche la costituzione dei composti ciclici può dar luogo a fenomeni di isomeria cis trans, facciamo un esempio:
ISOMERIA OTTICA
Prendiamo in esame la figura sotto riportata
Si tratta di due strutture che sono l’una l’immagine speculare dell’altra.
Possiamo facilmente notare che è impossibile sovrapporre le due figure in modo completo, si tratta perciò di due isomeri.
Vengono definiti ENANTIOMERI, due stereoisomeri che sono l’uno l’immagine speculare dell’altro non sovrapponibile.
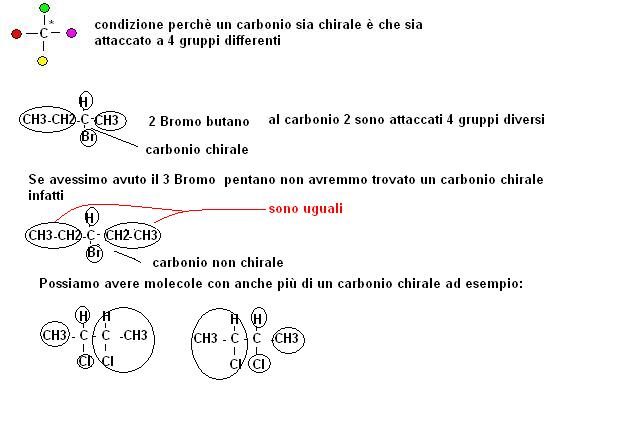
Affinché un composto organico possa risultare enantiomero occorre che esso abbia almeno un atomo di carbonio attaccato a 4 gruppi diversi (nella foto all’atomo di carbonio nero centrale sono attaccati 4 gruppi diversi, rosso, bianco, verde e nero).
Viene definito CHIRALE un atomo di carbonio a cui sono attaccati 4 gruppi diversi e che quindi può originare un enantiomero.
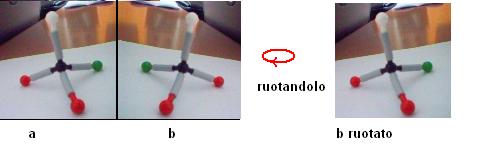
Osserviamo ora la figura sottostante:
La figura “a” e la figura “b” sono due immagini speculari, ma all’atomo centrale non sono attaccati 4 gruppi diversi (due atomi sono infatti rossi), ne consegue che ruotando la figura “b” si ottiene esattamente la figura “a”.
I composti “a” e “b” non sono quindi isomeri, ma sono esattamente la stessa sostanza.
Proviamo a riconoscere tra le molecole sotto riportate quali abbiano dei carboni chirali e che quindi possano originare degli enantiomeri.
Due stereoisomeri che non sono l’immagine speculare l’uno dell’altro vengono definiti DIASTEROISOMERI.
Sono perciò diasteroisomeri ad esempio gli isomeri cis e trans.
Mentre i diasteroisomeri hanno proprietà chimiche simili, ma proprietà fisiche in genere differenti, gli enantiomeri hanno proprietà chimiche praticamente identiche ed un unica proprietà fisica differente.
Questa proprietà fisica diversa è il senso di rotazione della luce polarizzata.
Sappiamo che la luce è formata da un insieme di radiazioni elettromagnetiche.
Se immaginiamo queste radiazioni come se fossero delle onde, ed immaginiamo che ogni onda identifichi un piano (in pratica come se disegnassimo delle onde su dei fogli di carta), potremmo immaginare la luce come un insieme di piani intersecanti passanti per la direzione di propagazione.
Nella luce polarizzata invece di infiniti piani, troviamo un unico piano su cui vibra la radiazione.
Gli enantiomeri possono ruotare il piano di una luce polarizzata e vengono per tanto definiti sostanze otticamente attive.
La differenza tra due enantiomeri è che mentre uno ruota la luce polarizzata verso sinistra, l’altro la ruota verso destra.
Una conseguenza di quanto abbiamo appena detto è che se si ottieme una miscela contenente il 50% di un enantiomero ed il 50% dell’altro enantiomero, gli effetti sulla rotazione della luce polarizzata verranno ad annullarsi. Miscele contenenti uguali percentuali di enantiomeri vengono definite RACEMI e non risultano otticamente attive.
Molte sostanze naturali risultano otticamente attive, ad esempio diversi zuccheri e diversi amminoacidi lo sono.
Gli zuccheri del mosto d’uva sono otticamente attivi per tanto con una semplice misurazione della rotazione del piano della luce polarizzata di una soluzione di mosto possiamo risalire alla concentrazione zuccherina dello stesso.
Questo è solo un esempio dell’importanze dell’attività ottica che troveremo molto spesso nell’analisi chimica degli alimenti.
Abbiamo già accennato che una sostanza può avere anche più carboni chirali.
Ogni carbonio chirale può originare due enantiomeri.
Il numero di enantiomeri massimo che si può formare quindi è pari a 2 elevato al numero di carboni chirali (2n con n= numero di carboni chirali).
Ad esempio
n= 1 enantiomeri = 2 (una coppia)
n= 2 enantiomeri = 4 (due coppie di enantiomeri che tra di loro saranno diasteroisomere)
Per comprendere quanto abbiamo detto facciamo un esempio pratico
Consideriamo la molecola
1,2dibromo 1 cloro propano
Questa molecola contiene due atomi chirali e quindi può formare 4 isomeri ottici
Il numero di isomeri otticamente attivi è al massimo 2n infatti in certe circostanze possono formarsi dei composti MESO.
I composti MESO sono molecole sovrapponibili alla loro immagine speculare sebbene presentino carboni chirali.
I composti meso, che non sono otticamente attivi, sono caratterizzati da presentare un asse di simmetria
Facciamo un esempio considerando il
1,2 dibromo 1,2dicloro butano