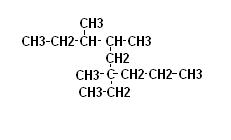L’ibridizzazione del carbonio
IBRIDIZZAZIONE SP3
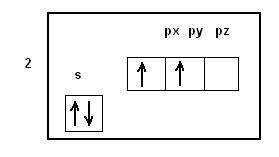
Prendiamo in considerazione la struttura elettronica del carbonio (n°Atomico = 6)
1s2
2s2 2 px py
Se esaminiamo l’ultimo livello energetico ci troviamo con 4 elettroni che dovrebbero essere disposti in questo modo:
Data la struttura elettronica ci aspetteremmo che il carbonio desse due legami coovalenti ed un legame dativo.
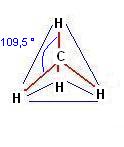
Se prendiamo in considerazione la struttura del metano CH4
Notiamo che essa presenta 4 legami coovalenti indistinguibili gli uni dagli altri.
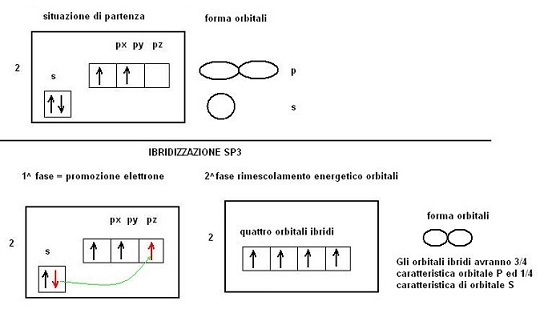
Ricordando che gli orbitale “S” sono di forma sferica, mentre quelli “P” a forma di “salsiccia”, il fatto di non riuscire a distinguere tra di loro i 4 legami del metano ci fa immaginare che un qualche cosa deve essere successo nella struttura elettronica del carbonio.
Possiamo pensare che un elettrone sia passato dall’orbitale 2S all’orbitale 2Pz e che poi ci sia stato un rimescolamento energetico tra l’orbitale S ed i tre orbitali P
Poichè questo fenomeno ha interessato un orbitale S e tre orbitali P il processo prenderà il nome di IBRIDIZZAZIONE SP3
Se consideriamo la molecola del metano dobbiamo pensare che gli orbitali ibridi del carbonio formino dei legami coovalenti con gli orbitali S dell’idrogeno.
Come ASSE DI LEGAME intendiamo una linea immaginaria che unisce due atomi interessati ad un legame, possiamo facilmente osservare come la sovrapposizione tra gli orbitali ibridi del carbonio e quelli dell’idrogeno avvenga lungo questo segmento
Quando gli orbitali si sovrappongono lungo l’asse di congiunzione dei due atomi, il legame risultante risulta particolarmente forte e viene indicato con la lettera greca sigma (σ).
IBRIDIZZAZIONE SP2
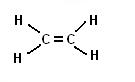
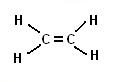
Prendiamo ora in considerazione un’altra molecola del carbonio, etiliene.
La formula di questo composto e C2H4 .
La molecola dell’etilene è così rappresentabile:
Per spiegare la formazione di questa molecola dobbiamo pensare ad un altro tipo di ibridizzazione del carbonio denominata SP2.
La prima fase della ibridizzazione SP2 è analoga a quella SP3 e consiste nella promozione di un elettrone dall’orbitale S all’orbitale Pz.
La seconda fase risulta, invece, differente in quanto il rimescolamento energetico interessa solo l’orbitale S e due orbitali P, mentre il terzo orbitale P non risulta interessato.
I tre orbitali ibridi si collocheranno su di un piano con angoli di 120°, mentre l’orbitale non ibrido si collocherà perpendicolarmente al piano.
Ne consegue che mentre gli orbitali ibridi potranno formare dei legami lungo l’asse di congiunzione degli atomi (legami sigma), gli orbitali non ibridi dei due carboni non potranno farlo.
In un doppio legame C=C uno dei due legami sarà quindi di tipo sigma, mentre l’altro no.
Un legame che non si manifesta lungo l’asse di legame viene chiamato pigreco (π)
I legami pigreco sono molto meno stabili di quelli sigma e possono pertanto rendere i composti che li contengono più reattivi.
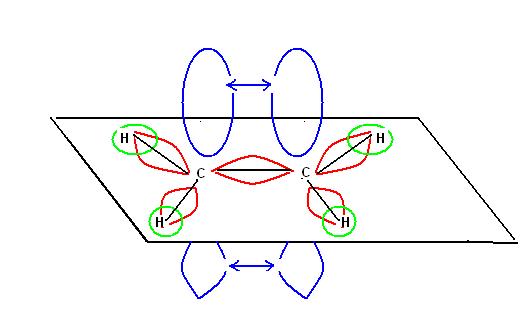
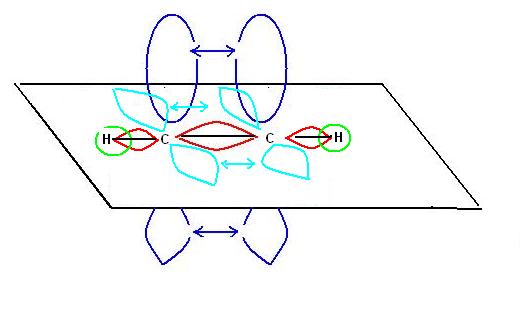
IBRIDIZZAZIONE SP
Terminiamo la nostra rassegna di possibili ibridizzazioni del carbonio considerando la molecola di acetilene:
Se abbiamo capito l’ibridizzazione SP2 non dovrebbe essere difficile capire come si possa formare un triplo legame tra i due atomi di carbonio.
Il meccanismo di ibridizzazione in questo caso va ad interessare solo l’orbitale S ed uno dei tre orbitali P (ibridizzazione SP), i rimanenti due orbitali non ibridizzati risultano inalterati e provocano la formazione di due legami pigreco.
Nella molecola di acetilene in corrispondenza del triplo legame troveremo quindi un legame di tipo sigma e due di tipo pigreco.
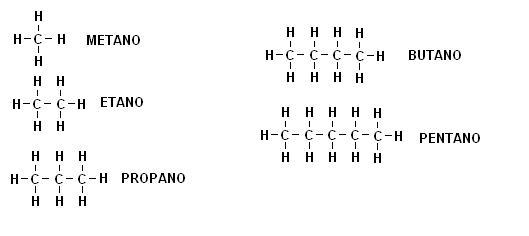
Gli ALCANI
Come abbiamo visto il metano è un composto in cui l’ibridizzazione del carbonio è di tipo sp3.
Una delle caratteristiche del carbonio è quella di potere formare delle catene praticamente infinite di atomi.
Il metano non è quindi altro che il capostipite di una famiglia di composti contenente carbonio ed idrogeno (idrocarburi) caratterizzati dal presentare tutti ibridizzazione sp3.
Questa famiglia prende il nome di ALCANI.
Nella tabella sottostante sono indicati gli alcani lineari con numero di atomi di carbonio compreso tra 1 e 5.
Il suffisso di tutti gli alcani, come possiamo osservare, corrisponde ad -ANO.
Gli alcani con numero di atomi maggiori a 5 avranno un prefisso che indica il numero di atomi di carbonio secondo la notazione greca, quindi al pentano seguirà l’esano, eptano, ottano, nonano, decano etc.
Dal punto di vista generale la formula di un alcano può essere riassunta come CnH(2n+2) dove n corrisponde al numero di carboni.
Ad esempio per il pentano n=5 quindi 2n+2= 12, la formula generale (bruta) di questo composto sarà:
C5H12.
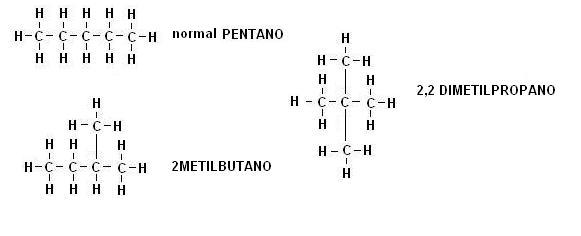
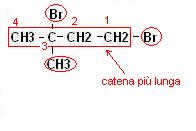
Gli alcani possono essere anche ramificati, prendiamo in considerazione ad esempio l’alcano C5H12 ; come possiamo osservare dalla figura sottostante esistono più composti con la stessa formula
Due composti che hanno la stessa formula bruta, ma una diversa struttura chimica vengono definiti ISOMERI.
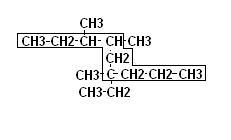
Le regole di nomenclatura per dare il nome agli alcani sono le seguenti (utilizziamo un composto ramificato come esempio):
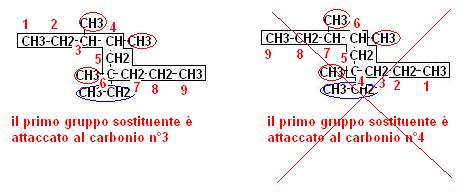
1. si considera la catena di atomi di carbonio lineare più lunga (nell’esempio di 9 carboni quindi derivato del NONANO)
2. si prendono in considerazione i gruppi ramificati alla catena principale attribuendo il numero minore all’atomo di carbonio in cui è attaccata la prima ramificazione
3. si prendono in considerazione per primi i gruppi più grandi oppure seguendo il criterio alfabetico.
I gruppi sostituenti prendono il suffisso -ILE (es CH3- = metile CH3-CH2-= etile segue propile, butile etc)
Il nome viene creato indicando la posizione in cui il gruppo sostituente è attaccato seguendo le regole dell’esempio sottoriportato
4. I gruppi sostituenti possono essere anche di natura diversa un caso molto frequente è quello degli alogenuri nei quali un idrogeno è sostituito con elementi del 7° gruppo (in genere cloro e bromo).
In questo caso si attribuisce ai gruppi una precedenza secondo l’ordine alfabetico, ma le regole di base sono sempre le stesse
ad esempio:
La molecola prenderà il nome di 1,3 dibromo 3 metil butano (notate che la numerazione prevede che il carbonio con il numero minore sia quello che ha attaccato il gruppo sostituente quindi chiamarlo 2,4 dibromo2 metil butano è un errore)
PROPRIETA’ CHIMICO-FISICHE DEGLI ALCANI
Gli alcani sono composti apolari o comunque poco polari, risultano quindi insolubili in acqua ed in altri solventi polari, mentre sono solubili in solventi apolari.
Le interazioni intermolecolari prevalenti negli alcani sono le interazioni di Van Der Wals che aumentano di probabilità all’aumentare della lunghezza dell’alcano.
Ne consegue che il punto di ebollizione e di fusione degli alcani cresce all’aumentare del numero di atomi di carbonio, infatti:
il metano e l’etano sono gas
il propano ed il butano sono liquidi sotto pressione
l’esano è un liquido ed gli alcani con più di dodici atomi di carbonio iniziano ad essere solidi.
A parità di atomi di carbonio gli alcani ramificati sviluppando meno interazioni intermolecolari hanno punti di ebollizione in genere più bassi.
Come abbiamo visto caratteristica degli alcani è quella di possedere solo legami di tipo sigma.
Poiché i legami sigma sono piuttosto forti gli alcani possono dare solo una limitata tipologia di reazioni chimiche ed in particolare:
1. reazioni di ossidazione (combustione)
2. reazioni di sostituzione
(1) REAZIONI DI OSSIDAZIONE (COMBUSTIONE)
Tutti i composti organici, e quindi anche gli alcani, possono essere bruciati e quindi subire una reazione di ossidazione.
In pratica questi composti con l’ossigeno possono ossidarsi ad anidride carbonica ed acqua con liberazione di energia.
Il processo in questione è ciò che normalmente avviene quando facciamo bruciare la benzina nelle camere di scoppio dei motori.
Se consideriamo come alcano di partenza ad esempio l’esano la reazione sarà la seguente
2C6H14 + 13O2 -> 12CO2 + 14H2O ΔG<0
La reazione è spontanea in quanto, come si può osservare, avviene sia con un aumento del numero (di moli e quindi sicuramente con un aumento del disordine), sia con lo sviluppo di energia (esotermica).
(2) REAZIONI DI SOSTITUZIONE
Oltre alle reazioni di ossidoriduzione i composti organici in generale possono subire altri tipi di reazioni che possono essere così classificate
· Reazioni di sostituzione A-B + C -> A-C + B (il numero di moli resta invariato)
· Reazioni di addizioni A + B -> A-B (il numero di moli diminuisce)
· Reazioni di sottrazione A-B -> A + B (il numero di moli aumenta, contrario reazioni di addizione, vengono anche denominate reazioni di decomposizione)
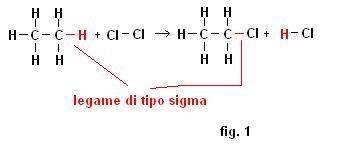
Tre questo tipo di reazioni solo le reazioni di sostituzione possono mantenere inalterata la natura dei legami, facciamo un esempio pratico
Come possiamo vedere la reazione è una sostituzione (due molecole avevamo prima e due molecole otteniamo poi), un cloro si è sostituito ad un idrogeno, ma questo fatto non ha modificato la tipologia dei legami che rimane sempre di tipo sigma.
Gli alcani non possono dare reazioni di addizione in quanto ci troveremmo ad avere atomi di carbonio legati a più di 4 molecole e non sono molto portati a dare reazioni di eliminazione in quanto dei legami sigma diventerebbero pigreco (formazione di un doppio legame).
Le reazioni tipiche degli alcani sono quindi delle sostituzioni ed in particolare delle sostituzioni radicaliche
Nella chimica organica, infatti le reazioni difficilmente avvengono in un unico passaggio, ma seguono dei percorsi di reazione spesso complessi.
Le reazioni di sostituzione degli alcani passano attraverso la formazione di intermedi denominati radicali.
Se dovessimo determinare la legge cinetica della reazione della fig.1 troveremmo una relazione di questo tipo
V = K [ CH3-CH3]
in altre parole anche aumentando la concentrazione del cloro (Cl2) la reazione non sarebbe più veloce.
Questo tipo di reazione inoltre avviene in presenza di radiazioni ultraviolette.
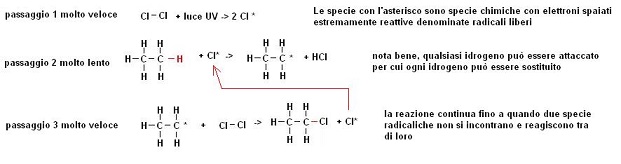
Si è quindi scoperto che il meccanismo della reazione è il seguente
Come si può osservare nel passaggio più lento è il secondo che non interessa la molecola di Cl2 , ciò spiega la legge cinetica.
Se la reazione viene prolungata altri atomi di cloro sostituiscono gli idrogeni per cui dalla reazione in genere si ottengono miscele di composti quali:
1cloroetano; 1,2dicloro etano; 1,1,2 tricloro etano; 1,1,2,2 tetracloro etano; 1,1,1,2,2 pentacloro etano e 1,1,1,2,2,2 esacloro etano.
Gli ALCHENI
Gli alcheni sono composti idrocarburici (contenenti C e H) in cui è presente almeno un doppio legame e nei quali per tanto è presente almeno un carbonio con l’ibridizzazione sp2.
La presenza di un doppio (ma anche di un triplo) legame in una molecola fa definire la stessa molecola come insatura (gli alcani, privi di doppi legami sono quindi idrocarburi saturi).
Poichè per formare un doppio legame occorrono almeno due atomi di carbonio il composto più semplice degli alcheni è il seguente:
Che abbiamo già incontrato con il nome di etene (o etilene).
Il suffisso degli alcheni è -ENE per cui:
propano diventa propene
butano diventa butene
pentano diventa pentene e via di seguito.
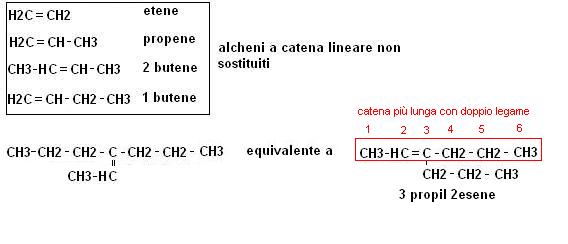
Le regole di nomenclatura degli alcheni sono simili a quelle degli alcani con due importanti eccezioni:
1. si prende in considerazione la catena più lunga contenente i doppi legami
2. la posizione del doppio legame va definita (la si omette in genere, sottointendendola, solo se è in posizione 1
facciamo degli esempi:
PROPRIETA’ CHIMICO-FISICHE DEGLI ALCHENI
Dal punto di vista fisico gli alcheni hanno proprietà molto simili a quelle degli alcani.
Diverso il discorso dal punto di vista chimico in quanto la presenza del legame pigreco sul doppio legame da agli alcheni una reattività molto maggiore.
Gli alcheni possono, infatti, dare tutte le reazioni caratteristiche degli alcani (tutti i carboni non interessati al doppio legame hanno l’ibridizzazione sp3), più delle reazioni specifiche.
Le reazioni più caratteristiche del doppio legame sono delle addizioni ed in particolare delle addizioni elettrofile.
Prima di parlare di queste reazioni bisogna descrivere cosa intendiamo come reattivi elettrofili.
Quando abbiamo parlato del concetto di acido e base abbiamo accennato alla teoria di Lewis.
Per questa teoria un acido è una sostanza in grado di accettare un doppietto elettronico, in pratica cioè una sostanza a cui “piacciono gli elettroni”, in altre parole elettrofila.
I reagenti elettrofili nella chimica organica sono quindi dei reattivi che hanno delle caratteristiche acide, ad esempio:
HCl (agente elettrofilo = H+ ; agente nucleofilo Cl–)
HBr (agente elettrofilo = H+ ; agente nucleofilo Br–)
H2O in ambiente acido (agente elettrofilo = H+ ; agente nucleofilo OH–)
I reagenti con caratteristiche basiche nella chimica organica vengono invece chiamati nucleofili.
Poichè in un legame pigreco sono presenti degli elettroni, e poichè questo legame non è particolarmente forte, se mettiamo un reagente elettrofilo a contatto con il doppio legame esso cercherà di strappare questi elettroni relativamente disponibili.
Quello che si verificherà in pratica è :
· la rottura del doppio legame
· l’addizione sugli atomi di carbonio interessati al doppio legame di due elementi
· la formazione di legami sigma
In termini generali possiamo dire che le reazioni di sostituzione interessano legami stabili, mentre le reazioni di addizione interessano prevalentemente legami meno stabili.
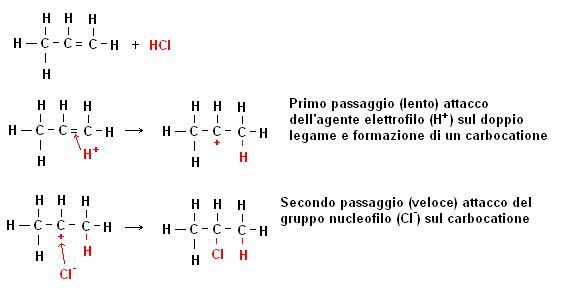
Ecco ad esempi la reazione di addizione elettrofila di HCl su etene
H2C-CH2 + HCl -> H3C-CH2Cl (da due molecole se ne ottiene una)
Anche in questo caso, così come abbiamo fatto per le reazioni di sostituzione radicalica degli alcani, è opportuno prendere in visione il meccanismo di reazione.
Nelle reazioni di addizione elettrofila il meccanismo di reazione avviene in due fasi:
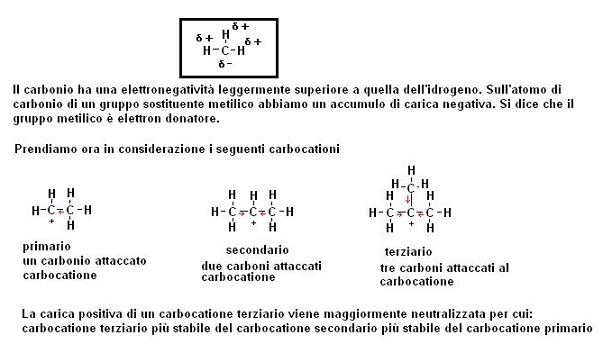
Il passaggio più difficile risulta essere la formazione del carbocatione, ne consegue che tutti i fattori che stabilizzano questa fase determineranno una maggiore velocità della reazione.
Come regola generale possiamo dire che un carbocatione più è sostituito più è stabile.
Facciamo un esempio:
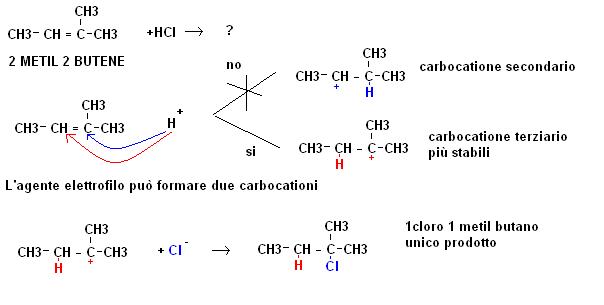
La stabilità del carbocatione spiega il motivo per cui molto spesso le reazioni di addizione elettrofila possano risultare selettive (portino alla formazioni di un unico prodotto); facciamo un altro esempio.
Nella pratica quindi l’agente elettrofilo (positivo) attacca il doppio legame formando il carbocatione più sostituito, in seguito l’agente nucleofilo (negativo) si attacca al carbocatione.
Oltre alla reazioni di addizione elettrofila, il doppio legame consente agli alcheni di dare altre reazioni caratteristiche, tra queste possiamo citare:
1. Idrogenazione (trasformazione di alcheni in alcani)
2. Ossidazione con permanganato di potassio (consente di distinguere alcheni da alcani)
1. L’idrogenazione si esegue con idrogeno e catalizzatore a base di platino, volendo fare un esempio
R – CH=CH – R’ + H2 -> R – CH2-CH2 – R’
alchene alcano
2. Il permanganato di potassio è una sostanza viola estremamente ossidante.
Gli alcheni sono più facilmente ossidabili degli alcani in quando hanno gli elettroni pigreco più facilmente disponibili, ne consegue che:
Alcano + KMnO4 (viola) -> non succede nulla rimane viola
Alchene + KMnO4 (viola) -> formazione di una colorazione marrone (si forma MnO2)
Va precisato che non solo gli alcheni reagiscono con il permanganato (lo fanno anche gli alchini, alcuni alcool e numerosi altre sostanze).
Gli ALCHINI
L’ultima categoria di idrocarburi che prendiamo in considerazione in questo capitolo sono gli alchini.
Questi composti sono caratterizzati dalla presenza di un triplo legame e quindi dall’avere almeno due carboni con ibridizzazione di tipo SP.
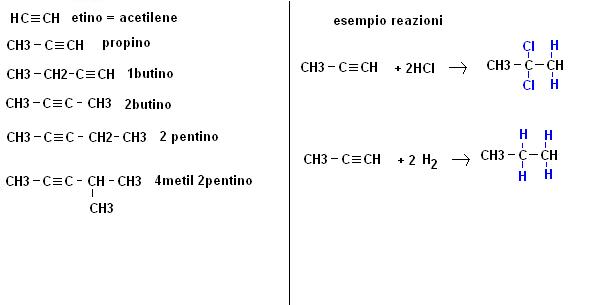
Dal punto di vista pratico gli alchini hanno caratteristiche molto simili a quelle degli alcheni e danno in prevalenza reazioni di addizione elettrofila (possono ovviamente addizionare 2 molecole invece che una).
La nomenclatura degli alchini è simile a quella degli alcheni con la sostituzione del suffisso ene in ino.
Avremo quindi i seguenti composti principali:
Facciamo un cenno ad una reazione storica che è stata utilizzata per molto tempo ad esempio nelle miniere per produrre acetilene.
La fiamma dell’acetilene è infatti molto luminosa e questo gas veniva quindi utilizzato per illuminare i cunicoli minerari.
In pratica i minatori avevano una scatolina contenente una sostanza solida (carburo di calcio).
Nella scatolina veniva fatta gocciolare dell’acqua che provocava la seguente reazione.
CaC2 + 2H2O -> C2H2 + Ca(OH)2 carburo di calcio + acqua = acetilene + idrossido di calcio
Attualmente l’acetilene viene ottenuto principalmente come derivato dell’industria petrolchimica.
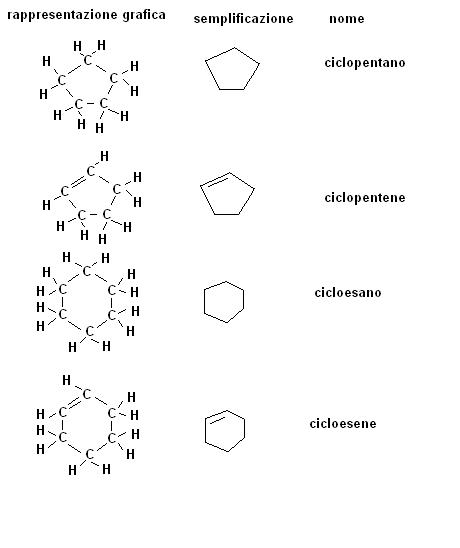
GLI IDROCARBURI CICLICI
Si parla di idrocarburi ciclici quando si hanno delle catene di atomi di carbonio che si chiudono ad anello.
Alcani, alcheni e alchini con più di tre atomi di carbonio possono formare composti ciclici che prenderanno rispettivamente il nome di cicloalcani, cicloalcheni e cicloalchini.
Come detto il numero minimo di atomi di carbonio per formare un composto ciclico e di tre, ma in realtà la struttura dei legami (angolo e lunghezza) fa si che solo con un numero di atomi maggiore di 4 si ottengano delle molecole stabili.
In altre parole, composti quali il ciclopropano ed il ciclobutano in realtà hanno una forte tendenza a rompersi e ritornare lineari.
Nella pratica i composti ciclici che si trovano maggiormente sono composti da 5 o 6 atomi di carbonio e possiamo rappresentarli come segue:
Le proprietà chimiche degli idrocarburi ciclici a 5, 6 atomi di carbonio sono molto simili a quelle degli omologhi lineari.
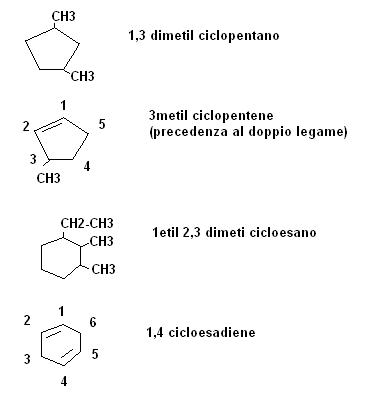
Per quanto riguarda le regole di nomenclatura facciamo qualche esempio