L’acqua
vedi anche pagine libro: da 15 a 19; da 52 a 55; da 65 a 67
Dal punto di vista chimico l’acqua è una molecola polare di formula H2O.
La polarità della molecola è dovuta:
1. Alla differenza di elettronegatività tra ossigeno e idrogeno
2. Dalla asimmetria della molecola dell’acqua.
L’acqua è in grado di formare dei legami ad idrogeno che ne spiegano il relativamente alto punto di ebollizione (specie se confrontato con molecole di analoga struttura).
Per le sue caratteristiche chimico-fisiche l’acqua è un ottimo solvente per tutte le sostanze polari, e quindi in grado di disciogliere una grande quantità di sostanze saline formando delle soluzioni.
Questo fatto spiega il motivo per il quale è estremamente difficile trovare acqua “pura” (distillata) l livello del terreno.
La dissoluzione di soluti nell’acqua provoca sempre delle conseguenze in particolare:
– Manifestazione delle proprietà colligative
– Possibile variazione della conducibilità elettrica (gli elettroliti conducono la corrente elettrica)
– Possibile variazione del pH (idrolisi acida o basica)
Le proprietà colligative e activity water.
Le proprietà fisico-chimiche di una soluzione sono diverse da quelle delle sostanze che la compongono.
Sperimentalmente si è potuto osservare che indipendentemente dalla natura chimica del soluto aggiunto una soluzione rispetto al solvente puro ha un punto di ebollizione maggiore ed un punto di fusione minore e che questi effetti sono tanto maggiori quanto più elevata risulta la concentrazione.
Queste proprietà legate alla concentrazione delle soluzioni prendono il nome di proprietà colligative ed in particolare abbassamento crioscopico (diminuzione punto di fusione) ed innalzamento ebullioscopico (aumento punto di ebollizione).
Possiamo interpretare questi fenomeni come una sorta di interferenza che il soluto compie nei passaggi di stato del solvente, ad esempio rendendo più difficile la formazione di un reticolo cristallino di ghiaccio.
Le proprietà colligative spiegano diversi comportamenti pratici, ad esempio l’uso di spargere il sale nelle strade ghiacciate o il comportamento dell’acqua in ebollizione quando ci versiamo sopra del sale.
Un altro fenomeno legato alla concentrazione delle soluzioni è la pressione osmotica.
Per comprendere questo fenomeno dobbiamo definire che cosa sia una membrana semipermeabile.
Una membrana semipermeabile è una membrana che consente il passaggio del solvente ma trattiene il soluto.
Esempi di membrane semipermeabili sono le pergamene e numerose membrane cellulari.
Immaginiamo di avere ora una soluzione concentrata trattenuta all’interno di una membrana semipermeabile immersa in una soluzione diluita.
Sperimentalmente noteremo che con il passare del tempo le concentrazioni all’interno e all’esterno della membrana tenderanno a equipararsi (si dice che diventano isotoniche).
Affinché avvenga questa equiparazione di concentrazioni deve essere avvenuto un flusso di solvente dalla soluzione più diluita a quella più concentrata, ciò si osserva anche dall’ingrandimento delle dimensioni della membrana semipermeabile (turgore) .
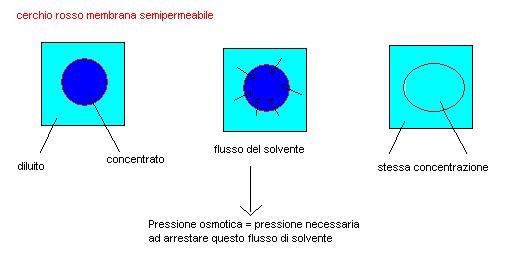
Definiamo pressione osmotica la pressione necessaria per arrestare il flusso spontaneo di solvente dalla zona più diluita a quella più concentrata di un sistema separato da una membrana semipermabile.
La pressione osmotica è uno dei fenomeni più importanti in natura, ad esempio il flusso di liquidi attraverso le piante è in gran parte garantito da fenomeni osmotici ed è in grado di spiegare il motivo per cui sia possibile conservare dei prodotti alimentari mediante salatura o grazie ad elevate concentrazioni zuccherine (vedi marmellate).
Negli alimenti infatti l’acqua può essere distinta in:
– Acqua libera
– Acqua legata
L’acqua libera è l’acqua presente nell’alimento che può essere facilmente utilizzata dai microorganismi, mentre l’acqua legata è l’acqua che pur presente negli alimenti non è in realtà disponibile in quanto per l’appunto “legata” in maniera chimico-fisica alla matrice dell’alimento.
E’ facilmente comprensibile che se nell’alimento la concentrazione in soluti è elevata, un microrganismo per assimilare l’acqua dovrà superare un valore di pressione osmotica che superato un certo limite non sarà più possibile raggiungere.
Per stabilire questo limite si definisce un parametro chiamato activity water (aw)
L’activity water che si ottiene dal rapporto tra la tensione di vapore dell’acqua dell’alimento e la tensione di vapore dell’acqua distillata è un valore compreso tra 0 e 1 (la maggior parte dei microrganismi si sviluppa tra valori di 0,91 e 0,95).
La tensione di vapore rappresenta la pressione esercitata dai vapori dell’acqua ad una certa temperatura.
Un liquido bolle quando la sua tensione di vapore uguaglia la pressione atmosferica.
L’innalzamento ebullioscopico è proprio dovuto al fatto che la presenza di soluti abbassando la tensione di vapore fa si che una soluzione debba raggiungere temperatura più alta affinché il valore della tensione raggiunga quello della pressione atmosferica.
Il ciclo dell’acqua
Il ciclo dell’acqua o ciclo idrologico è un complesso sistema di cambiamenti di stato che consente il continuo ricambio dell’acqua a livello sotterraneo, superficiale ed atmosferico.
Il motore di questo sistema è ovviamente il sole che consente all’acqua superficiale grazie a fenomeni di evaporazione e di traspirazione (delle piante) di passare allo stato aeriforme.
L’allontanamento di acqua dalla superficie contribuisce a seguito di fenomeni di capillarità, assorbimento radicale etc a richiamare acqua dagli strati più profondi del terreno.
L’acqua allo stato aeriforme (vapore) contiene una grande quantità di energia sottoforma di calore latente (questo spiega l’intensità energetica di alcuni fenomeni meteorologici) che viene restituita in fase di condensazione in pioggia, neve o grandine.
L’acqua meteorica (praticamente distillata) ricade quindi nel terreno alimentando i corsi d’acqua dolce ed arricchendosi sempre più di sali fino a raggiungere valori di concentrazione salina tipici dei mari e facendo ricominciare il ciclo.
L’acqua nel corpo umano
Il corpo umano è costituito per circa il 75% di acqua.
L’acqua è presente sia all’interno che all’esterno delle cellule (acqua intra ed extra cellulare) e pur non fornendo energia è fondamentale per la nostra vita.
Praticamente tutte le reazioni biochimiche del nostro organismo si svolgono in ambiente acquoso ed in taluni casi l’acqua rappresenta un vero e proprio reagente chimico (entra nella stechiometria della reazione).
Inoltre l’acqua è il principale fluido di trasporto per il nutrimento cellulare e per l’eliminazione delle scorie e svolge un ruolo fondamentale nella termoregolazione (vedi sudore).
Per gli organismi viventi si parla di bilancio idrico come la risultante dell’acqua assimilata e di quella persa dall’organismo stesso.
L’acqua può essere assimilata attraverso cibo e bevande (acqua esogena) ed in parte può essere “prodotta” da reazioni chimiche legate al metabolismo (acqua endogena).
Le necessità di acqua cambiano in relazione allo sforzo fisico, all’età, alla termoregolazione, alla digestione di alimenti, al riequilibrio di elettroliti persi o assunti (esempio il sale aumenta la necessità di acqua).
Sempre tenendo in considerazione fenomeni osmotici è facilmente comprensibile come scompensi si possano avere sia per scarsità di acqua (disidratazione), sia per un suo forte eccesso (intossicazione da acqua).
I sali minerali
I sali minerali presenti negli alimenti non rivestono funzioni energetiche o di apporto calorico, ma possono e giocano importanti ruoli nel metabolismo.
Sulla base funzionale possiamo suddividere i sali minerali in due grandi classi:
1. i macrocomponenti
2. i microcomponenti
I macrocomponenti sono i sali minerali che sono richiesti dall’organismo in quantità relativamente alte, tra questi troviamo:
-
il sodio: principale catione dei fluidi extracellulari gioca insieme al potassio un ruolo fondamentale per gli scambi osmotici tra le cellule
-
il potassio: principale catione intracellulare, l’equilibrio K/Na contribuisce a stabilire la pressione arteriosa ed il funzionamento del cuore
-
il calcio: oltre ad essere costituente delle ossa gioca un importante ruolo nel funzionamento dei muscoli. Il tasso di calcio, infatti, determina la contrazione o il rilassamento delle masse muscolari.
-
il magnesio: è un catione fondamentale per il funzionamento di diversi enzimi (ad esempio quasi tutti quelli della glicolisi e del ciclo di Krebbs richiedono magnesio)
-
il fosforo: insieme al calcio è il principale costituente delle ossa, inoltre è un componente dell’ATP e di tutti i derivati fosforilati che partecipano alle vie metaboliche.
-
lo zolfo: entra nella costituzione degli aminoacidi solforati, cisteina e metionina, oltre che nella vitamina H ed in altri composti
-
il cloro: sottoforma di ione cloruro è il principale gruppo anionico dell’organismo, entra nel meccanismo di formazione dell’acido cloridrico gastrico.
I microcomponenti sono i sali minerali che sono richiesti dall’organismo in quantità minime ed anzi, molto spesso, se presenti in eccesso possono dare importanti intossicazioni.
In genere i microelementi sono gruppi metallici necessari per il funzionamento di alcuni enzimi o alcuni ormoni. Tra i microcomponenti troviamo:
-
il ferro: serve per produrre l’emoglobina e quindi i globuli rossi. La sua carenza provoca l’anemia
-
lo iodio: entra nella formazione degli ormoni tiroidei, la sua carenza provoca il gozzo
-
il rame: partecipa alla sintesi dell’emoglobina ed è presente in enzimi legati alla respirazione (in eccesso tossico
-
altri: selenio, cobalto, zinco etc (per molti elementi sono in corso studi per stabilire se hanno funzioni biologiche).
Acque destinate al consumo umano (acque potabili)
Tutte le acque destinate direttamente o indirettamente al consumo umano devono rispettare diverse normative.
La legge di riferimento in Italia è il DL n°3 del 2001 che ha recepito la direttiva 98/83 CE, e che non si applica alle acque minerali, identifica dei requisiti di salubrità e di gradevolezza per le acque destinate al consumo umano.
In termine di salubrità vengono identificati dei limiti inerenti inquinamento microbiologico e inquinamento chimico.
Per le sostanze chimiche sono previsti dei limiti specifici per ogni tipo di sostanza pericolosa per la salute, mentre per gli inquinanti microbici viene sancita l’assenza di contaminanti fecali (Coliformi e Streptococchi fecali).
Va in ogni caso ricordato che il concetto di potabilità assoluta è solo un utopia infatti quello che possiamo appurare dalle analisi è solo la non rilevabilità di una sostanza in base ai parametri del metodo utilizzato e non la totale assenza di essa.
In termini di gradevolezza si definiscono dei requisiti organolettici che devono definire l’acqua accettabile per il consumatore (assenza di percezioni organolettiche anomale).
Visto i requisiti che l’acqua per il consumo umano deve avere appare evidente l’esigenza di impianti di potabilizzazione che saranno mirati alla correzione di :
– caratteri chimici
– caratteri microbiologici
La correzione dei caratteri chimici è ovviamente mirata a fare ricadere la composizione dell’acqua entro i limiti previsti dalla normativa, la presenza di metalli pesanti, pesticidi e altri composti inquinanti nell’acqua rende ovviamente sempre più difficile e costoso questo processo.
Le sostanze chimiche possono essere allontanate con specifiche reazioni di precipitazione o attraverso l’uso di resine a scambio cationico (trattengono gli ioni indesiderati sostituendoli con altri non tossici).
La sostanza organica viene in genere eliminata con trattamenti aerobi (fanghi attivi) e anaerobi (digestori).
I composti insolubili che si formano (organici ed inorganici) vengono allontanati attraverso processi di decantazione, filtrazione o con l’aggiunta di flocculanti (sostanze di tipo gelatinoso che depositandosi trascinano verso il basso tutte le sostanze solide che incontrano).
Un’altra correzione che viene eseguita è in relazione alla durezza e sarà trattata più avanti.
La correzione microbiologica può essere condotta con diverse tecniche tra essi i più importanti sono:
– ozonizzazione: utilizzo di ozono gas molto ossidante applicabile ad acque non molto inquinate
– clorazione: utilizzo di cloro o derivati, tecnica più utilizzata)
La clorazione viene condotta in genere con ipoclorito di sodio (candeggina) o acido ipocloroso.
HClO (acido ipocloroso) NaClO (ipoclorito di sodio)
In ambiente acido si decompongono liberando cloro gassoso
2 HClO + 2H++ 2 e–→ Cl2+ 2H2O
L’acido ipocloroso o i suoi sali, hanno una energica azione battericida legata all’azione del cloro che queste sostanze liberano decomponendosi.
Poiché l’acqua inquinata non contiene solo batteri nel dosare il cloro (e quindi l’ipoclorito) va tenuto conto della quantità che esso viene consumato per ossidare tutte le sostanze presenti nell’acqua stessa.
La soglia di cloro consumata prima che ci sia effettivamente del cloro attivo (efficace contro i batteri) viene chiamata break point.
In genere i trattamenti di potabilizzazione utilizzano un quantitativo superiore a quello del break point per due motivi:
-
sicurezza dell’efficacia del trattamento sui microrganismi
-
fermandosi al break point le sostanze ossidate dal cloro di natura organica formano delle cloramine che hanno odori sgradevoli e che vengono scomposte dall’eccesso di cloro (a volte l’acqua che “sa di cloro” è dovuta allo scarso utilizzo di cloro
Addolcimento dell’acqua (durezza)
La durezza dell’acqua è un parametro legato alla concentrazione in soluzione di ioni calcio e magnesio.
Le procedure di addolcimento dell’acqua sono quelle mirate ad una riduzione della sua durezza.
La durezza dell’acqua determina, come vedremo, non tanto problematiche legate alla potabilizzazione, ma più che altro problematiche legate all’uso industriale dell’acqua stessa.
Un’acqua dura, infatti, provoca facilmente incrostazioni che negli impianti industriali possono avere effetti deleteri soprattutto nelle apparecchiature destinate al riscaldamento (scambiatori di calore).
Un altro problema legato alle acque dure è legato alla detergenza, i saponi infatti (Sali sodici/potassici) degli acidi grassi vengono resi inattivi dalla presenza di ioni di calcio o di magnesio, questo spiega come mai il dosaggio dei detersivi nelle lavatrici dipenda dalla durezza dell’acqua impiegata.
Ci sono diversi tipi di durezza:
Durezza totale: si riferisce al contenuto di Sali di Ca++ e di Mg++ presenti in soluzione, in genere viene espressa in gradi francesi (°F) che corrispondono a 10mg/l di CaCO3
Si determina ad esempio il contenuto in moli di ioni calcio e si risale stechiometricamente al contenuto teorico di carbonato di calcio,
Sulla base di questo parametro le acque possono essere distinte in:
– dolci fino a 5°F
– moderatamente dure 5-20 °F
– dure 20-30 °F
– molto dure > 30°F
Durezza temporanea: è un tipo di durezza dovuta ai bicarbonati di calcio e di magnesio
Ca(HCO3)2 = bicarbonato di calcio Mg(HCO3)2 = bicarbonato di magnesio
Questi sali sono solubili, ma quando vengono riscaldati si trasformano nei relativi carbonati che risultano invece insolubili.
Ca(HCO3)2 + calore → CaCO3 (insolubile) + CO2 + H2O
Appare evidente che la durezza temporanea è particolarmente negativa per gli scambiatori di calore e tutte le apparecchiature destinate a riscaldare l’acqua.
Durezza permanente: è il risultato della differenza tra quella totale e quella temporanea, in pratica si fa una determinazione della durezza sull’acqua tal quale (durezza totale) e una dopo averla fatta bollire (durezza permanente) la differenza tra i due valori è la durezza temporanea.
Industrialmente l’acqua può essere addolcita:
1. con resine a scambio cationico
2. con metodo di precipitazione calce soda
Le resine a scambio cationico sono delle sostanze che in pratica fissano i cationi di Calcio e Magnesio e rilasciano al loro posto cationi H+
Il metodo di precipitazione invece utilizza (come si evince dal nome): calce (idrossido di calcio) e soda (carbonato di sodio).
La calce fa infatti precipitare i bicarbonati di calcio e magnesio (elimina la durezza temporanea)
Ca(HCO3)2 + Ca(OH)2 → 2 CaCO3 (insolubile) + 2H2O
Mentre la soda fa precipitare i Sali solubili di calcio o magnesio (ad esempio cloruro di calcio) eliminando la durezza permanente.
CaCl2 + Na2CO3→ CaCO3 (insolubile) + 2NaCl
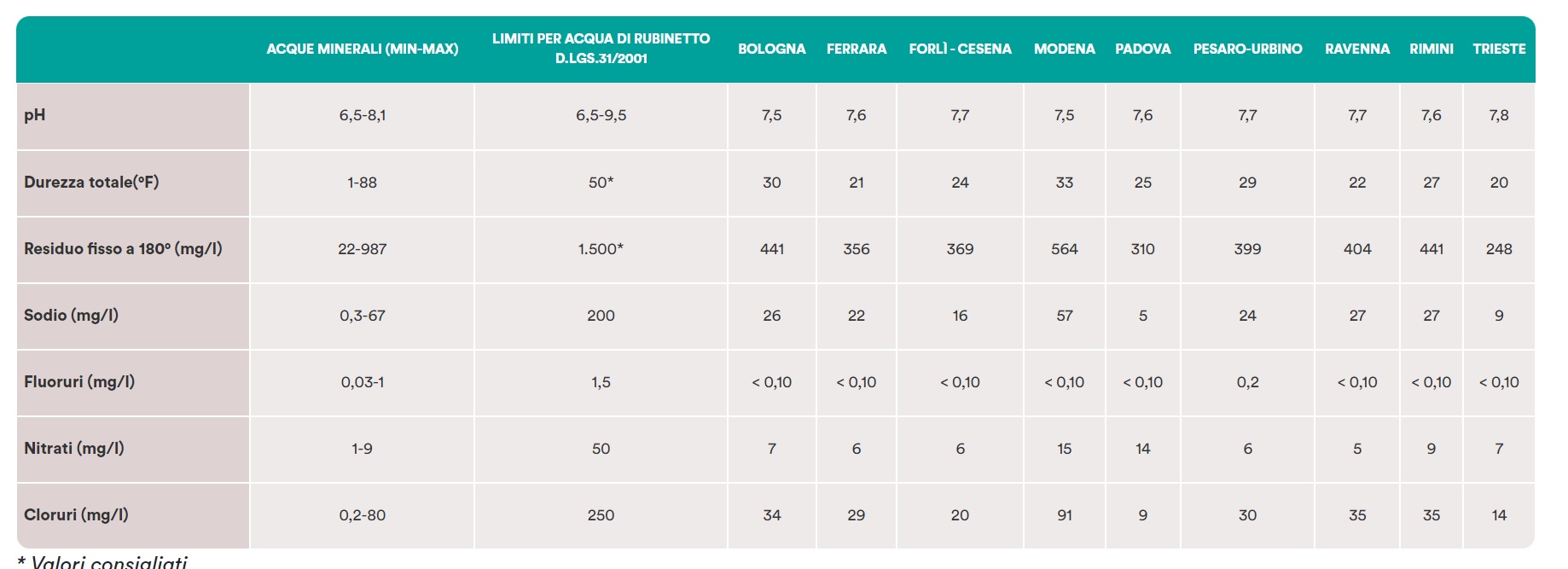
Caratteristiche acqua acquedotto Ravenna (Estratto sito https://www.gruppohera.it/offerte-e-servizi/casa/acqua/che-acqua-bevi)
Acque minerali
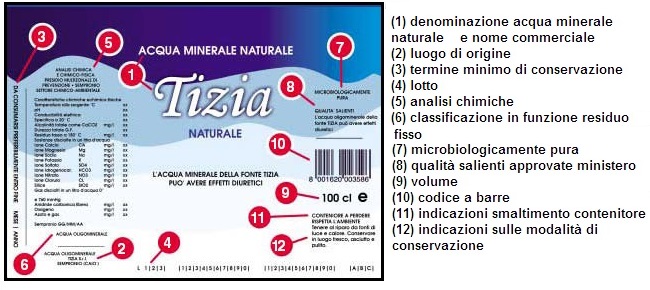
Secondo la normativa vigente vengono considerate acque minerali “le acque che avendo origine da una falda o giacimento sotterraneo, provengono da una o più sorgenti naturali o perforate e che hanno caratteristiche igieniche particolari e, eventualmente, proprietà favorevoli alla salute.
L’acqua minerale deve essere imbottigliata nel luogo di estrazione ed e’ vietato su di essa qualsiasi trattamento di potabilizzazione (consentita l’aggiunta di anidride carbonica).
La salubrità dell’acqua minerale deve essere garantita da analisi condotte da laboratori universitari autorizzati.
Un parametro fondamentale per le acque minerali è il residuo fisso.
Come residuo fisso intendiamo ciò che rimane (in grammi) da un litro di acqua dopo averla fatta evaporare a 180 °C.
E’ abbastanza logico pensare che nel residuo fisso siano contenuti i Sali precedentemente disciolti in acqua e che quindi questo parametro sia legato anche alla conducibilità elettrica dell’acqua in questione.
In relazione al residuo fisso distinguiamo in acque:
1. minimamente mineralizzate (residuo < 50 mg/l)
2. oligominerali (residuo tra 50 e 500 mg/l)
3. minerali (residuo tra 500 e 1500 mg/l)
4. fortemente mineralizzate (residuo > 1500 mg/l)
Le acque minerali devono essere adeguatamente etichettate