Gli alcool, i composti carbonilici e gli acidi carbossilici
Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai due elementi principali (C e H) anche atomi di ossigeno.
Si parla di gruppi funzionali quando all’interno di una molecola organica sono presenti aree contenenti atomi diversi rispetto al carbonio e idrogeno.
Abbiamo in precedenza visto come dagli alcani, alcheni e alchini si possano originare dei derivati alogenati, e come sia possibile attraverso reazioni di sostituzione elettrofila sugli aromatici ottenere derivati quali fenoli, nitrobenzeni etc.
La presenza di gruppi funzionali può modificare sostanzialmente le caratteristiche chimico fisiche della molecola.
Nella nostra trattazione ci limiteremo a considerare solo alcuni dei numerosi gruppi funzionali ed in particolare gli alcool, i composti carbonilici (aldeidi e chetoni) e gli acidi carbossilici.
Durante la spiegazione potremo trovare di tanto in tanto composti indicati con una generica lettera R o Ar.
Con la lettera R indichiamo dei residui generici di idrocarburi alchilici, mentre con la lettera Ar dei residui generici a carattere aromatico.
Ad esempio se scrivo R-Cl mi posso riferire ad un composto quale:
cloro butano, cloro etano, cloro etene etc.
Se scrivo, invece Ar-Cl mi posso riferire ad un composto quale:
cloro benzene, para cloro toluene etc.
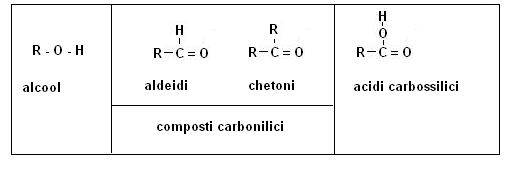
Gli alcool, i composti carbonilici e gli acidi carbossilici sono in relazione tra di loro in base allo stato di ossidazione.
Gli alcool sono i composti meno ossidati (maggiormente ridotti), gli acidi carbossilici sono i composti più ossidati (meno ridotti), mentre i composti carbonilici si trovano in una condizione intermedia.
Il gruppo alcoolico può essere indicato come R-OH
Il gruppo carbossilico come R-COOH
mentre il gruppo carbonilico può esistere in due forme
· la forma aldeide R-CO-H
· la forma chetone R-CO-R
Prendiamo ora in considerazione singolarmente le caratteristiche degli alcool, dei composti carbonilici e degli acidi carbossilici.
Gli alcool
Proprietà fisiche
I composti nei quali atomi di idrogeno sono uniti ad elementi molto elettronegativi quali, azoto, fluoro o ossigeno possono dare legami ad idrogeno.
Gli alcool avendo un atomo di idrogeno unito ad un atomo ad idrogeno possono quindi dare questi legami intermolecolari e presentano perciò punti di ebollizione e di fusione nettamente superiori a quelli degli alcani, alcheni e alchini.
Tra due alcool il punto di ebollizione è maggiore tanto è maggiore il numero di atomi di carboni, mentre diminuisce ( a parità di numero di atomi di carbonio) se sono presenti ramificazioni.
Poiché il gruppo OH è polare mentre la catena idrocarburica R non lo è, la solubilità in acqua degli alcool diminuirà all’aumentare del numero di atomi di carbonio presenti nella molecola.
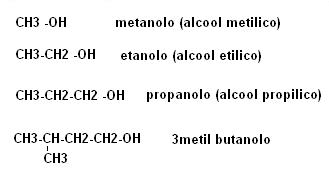
Nomenclatura
Per gli alcool sono molto in uso nomi correnti (ad esempio alcool etilico, propilico etc) le regole IUPAC di nomenclatura prevedono per questi composti il suffisso olo.
Si prende in considerazione la catena più lunga contenente l’OH e si indica con il numero più basso il carbonio ad esso attaccato, per eventuali altri gruppi funzionali valgono le solite regole.
Produzione degli alcool
A livello industriale gli alcool vengono prodotti con due procedimenti principali:
1. fermentazione degli zuccheri
2. addizione elettrofila di acqua agli alcheni
1) Si tratta del metodo più utilizzato per ottenere etanolo soprattutto per fini alimentari (gli alcool ottenuti per addizione elettrofila non possono essere usati per fini alimentari).
In genere vengono utilizzati dei lieviti (anaerobi facoltativi) che trasformano l’acido piruvico derivante dalla glicolisi in alcool etilico ottenendo così della energia.
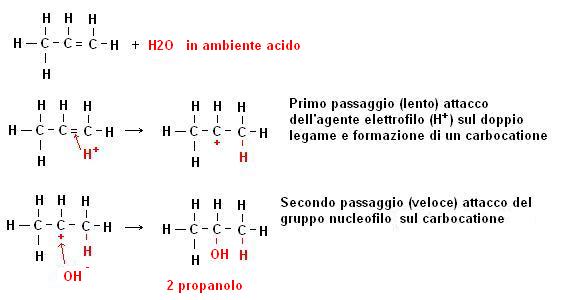
2) Si tratta della reazione di addizione elettrofila con acqua in ambiente acido sugli alcheni che abbiamo già visto nel capitolo dedicato.
Con questa reazione si possono ottenere diversi tipi di alcooli
Reazioni degli alcool
Le reazioni degli alcool possono essere distinte in tre grandi categorie:
1. quelle che portano al distacco del gruppo -OH (alcool come basi)
2. quelle che portano al distacco del gruppo -H (alcool come acido)
3. reazioni di ossidazione
4. altre reazioni
1 ) —– reazioni in cui gli alcool si comportano come basi ——
In questo tipo di reazioni gli alcool perdono il gruppo OH secondo lo schema:
ROH -> R+ + OH–
Si tratta di reazioni che avvengono per lo più con acidi o in ambiente acido tra queste abbiamo:
· Reazioni con acidi alogenidrici (in particolare HCl e HBr)
Prendiamo come esempio l’acido cloridrico ed un generico alcool.
La reazione è la seguente:
ROH + HCl -> RCl + H2O
Come possiamo vedere si tratta di una reazione di sostituzione (il numero di moli di reagenti e di prodotti non cambia) e poiché viene scambiato un gruppo OH– con un gruppo Cl–, ossia dei gruppi nucleofili possiamo definire questa reazione come sostituzione nucleofila.
· Reazioni di disidratazione (formazione di alcheni)
Si tratta della reazione inversa all’addizione elettrofila di acqua agli alcheni (che ricordiamo portava alla formazione di alcool).
Trattando un alcool in ambiente alcalino con calore viene eliminata una molecola di acqua e si provoca la formazione del rispettivo alchene.
La reazione in questione può essere intesa come un equilibrio in cui la modifica delle condizioni operative può variare l’orientamento.
2 ) —– reazioni in cui gli alcool si comportano come acidi ——
Gli alcool possono essere considerati degli acidi molto deboli in quanto l’equilibrio:
ROH <-> RO– + H+ è spostato molto verso sinistra.
La specie chimica RO– non è per niente stabile e quindi questa reazione è poco favorita.
Ne consegue che gli alcool reagiscono solo con basi fortissime.
Ad esempio non reagiscono nemmeno con l’idrossido di sodio (base forte) ma solo con il molto più reattivo sodio metallico liberando idrogeno gassoso
2 ROH + 2Na -> 2RONa + H2
(alcoolato di sodio)
Discorso diverso per i fenoli, (alcool aromatici di formula Ar-OH) in questo caso infatti abbiamo dei composti molto più acidi.
I fenoli sono quindi in grado di reagire con basi molto meno forti del sodio metallico.
3) —– reazioni di ossidazione ——
Gli alcool come tutti i composti organici possono essere ossidati completamente ad anidride carbonica e acqua attraverso reazioni di combustione.
Le reazioni di ossidazione a cui ci riferiamo sono ovviamente reazioni di ossidazione parziale che non implicano la rottura dei legami carbonio-carbonio.
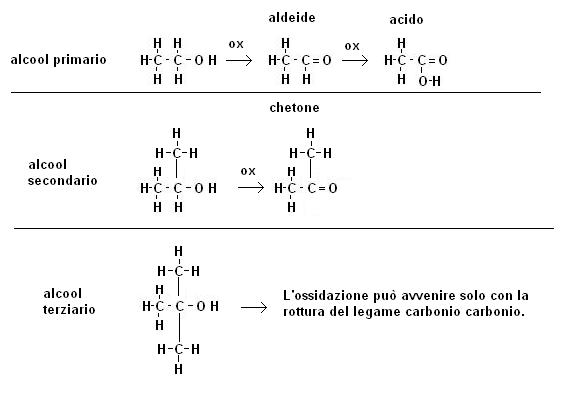
Come abbiamo già citato gli alcool possono essere ossidati a composti carbonilici e a composti carbossilici.
Non tutti gli alcool però vengono o possono essere ossidati in maniera analoga, dobbiamo infatti distinguere il comportamento di alcool primari, da quello di alcool secondari e terziari
Come possiamo osservare:
· gli alcool primari possono subire una ossidazione parziale ad aldeidi ed una più spinta ad acidi carbossilici
· gli alcool secondari possono essere ossidati solo a chetoni
· gli alcool terziari non possono essere ossidati senza la rottura di legami carbonio-carbonio
Ne consegue che se abbiamo una sostanza che sappiamo essere alcoolica e la trattiamo con permanganato di potassio, nel caso in cui non si verifichi modifica del colore del permanganato (sua riduzione) possiamo stabilire che la sostanza in esame è un alcool terziario.
4) —– altre reazioni——
Gli alcool possono reagire sia con i composti carbonilici (aldeidi e chetoni) dando reazioni di addizione nucleofila, sia con gli acidi carbossilici formando dei composti chiamati esteri.
Queste reazioni verranno però trattate nei capitoli riferiti ai composti carbonilici e carbossilici.
I composti carbonilici
Come abbiamo gia avuto occasione di dire i composti carbonilici sono caratterizzati dalla presenza del gruppo C=O e possono essere distinti in aldeidi e chetoni
Nelle aldeidi il carbonio del gruppo C=O è unito ad almeno un atomo di idrogeno, mentre nei chetoni il carbonio in questione è unito ad altri due atomi di carbonio.
Le aldeidi si ossidano più facilmente dei chetoni ed in genere risultano più reattive.
Nomenclatura
Aldeidi: la nomenclatura IUPAC delle aldeidi prevede di prendere in considerazione la catena più lunga contenente il gruppo carbonilico utilizzando il suffisso ale.
Molto utilizzata però è ancora la nomenclatura tradizionale.
Nella figura sotto riportata vengono fatti alcuni esempi di nomenclatura IUPAC e tradizionale delle aldeidi
Chetoni per la nomenclatura IUPAC viene utilizzato il suffisso one, in pratica valgono le solite regole.
Anche in questo caso viene abbondantemente ancora utilizzata la vecchia nomenclatura, vedi esempi
Proprietà fisiche
I composti carbonilici non hanno atomi di idrogeno uniti all’ossigeno e non possono per tanto dare legami ad idrogeno intermolecolari.
L’ossigeno del gruppo carbonilico può però dare interazioni con le molecole di acqua, ne consegue che:
· aldeidi e chetoni sono composti che hanno un centro polare
· fino a quattro atomi di carbonio sono solubili in acqua
· hanno punti di ebollizioni inferiori a quelli degli alcool o degli acidi carbossilici corrispondenti, ma sempre superiori a quelli degli alcani, alcheni o alchini di pari peso molecolare.
Reazioni delle aldeidi e dei chetoni
sono principalmente di due tipi
1. ossidazioni/riduzioni
2. addizioni nucleofile
1) —– reazioni di ossidazione/riduzione ——
Come abbiamo gia visto le aldeidi ed i chetoni possono essere prodotte per ossidazione dei rispettivi alcool (primari per le aldeidi, secondari per i chetoni).
Ovviamente utilizzando un reattivo riducente si può riottenere partendo dalle aldeidi ed i chetoni i rispettivi alcool (reazione inversa).
Abbiamo già citato come le aldeidi possano essere ulteriormente ossidate ad acidi carbossilici, mentre i chetoni possono essere ossidati solo da agenti ossidanti piuttosto forti (l’ossidazione dei chetoni prevede la rottura dei legami C-C).
La maggiore facilità di ossidazione delle aldeidi rispetto ad i chetoni consente di avere a disposizione un metodo piuttosto facile per riconoscere questi composti.
Due tipi di reattivi sono frequentemente utilizzati sia per riconoscere le aldeidi dai chetoni che per determinare quantitativamente le aldeidi.
· reattivo di Tollens
si tratta di un reattivo a base di sale di argento (Ag+).
Questo ione è un debole ossidante potendosi ridurre ad argento metallico.
Aggiungendo il reattivo di Tollens ad una soluzione contenente un aldeide si potrà vedere la formazione di uno specchio argentato all’interno della provetta.
Questa reazione non avviene se il reattivo di Tollens viene aggiunto a dei chetoni
· reattivo di Feehling
Si tratta di un reattivo a base di sale di rame (Cu++) in ambiente basico.
In presenza di aldeidi il rame Cu++ (blu) viene ridotto a Cu+ sottoforma di Cu2O di colore rosso.
Questa reazione viene utilizzata in generale per dosare quantitativamente le aldeidi.
Va sottolineato che visto che alcuni tipi di zucchero (ad esempio il glucosio) hanno un gruppo aldeidico libero il reattivo di Feelhing viene anche utilizzato per determinare le quantità zuccherine ad esempio nei mosti, nelle melasse o in altre sostanze alimentari.
2) —– reazioni di addizione nucleofila ——
Sono le reazioni più caratteristiche del gruppo carbonilico.
Il meccanismo di reazione è il seguente, detto z– un generico agente nucleofilo avremo:
Un esempio di addizione nucleofila è la reazione di un’aldeide o di un chetone con l’acido cianidrico (HCN):
Anche gli alcool possono reagire con i gruppi carbonilici dando reazioni di addizione nucleofila (lo ione OH– proveniente da un alcool è un tipico agente nucleofilo.
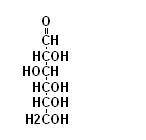
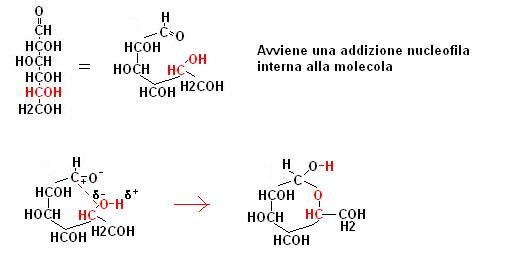
Un caso particolare di una reazione tra un gruppo carbonilico ed uno alcoolico avviene nelle molecole di zucchero quale ad esempio il glucosio.
Nella molecola di glucosio sono contemporaneamente presenti un gruppo carbossilico e diversi gruppi alcoolici.
Se consideriamo la reale conformazione dello zucchero notiamo che il carbonio carbossilico si trova molto vicino al carbonio n°5.
La vicinanza tra il gruppo alcoolico del carbonio 5 ed il gruppo carbonilico consente che avvenga la seguente reazione.
Si forma quindi un composto ciclico (5 atomi di carbonio + 1 atomo di ossigeno) chiamato semiacetale
che è la rappresenta la reale forma in cui si presentano molti zuccheri.
Gli acidi carbossilici
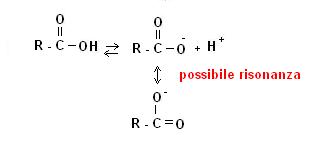
Si tratta dei composti contenenti il gruppo carbossilico -COOH.
La natura acida di queste sostanze è dovuta ad una forma di risonanza che rende abbastanza stabile lo ione COO–
Nonostante la loro natura acida, gli acidi carbossilici presentano valori di Ka< 1 è sono quindi da ritenere acidi deboli.
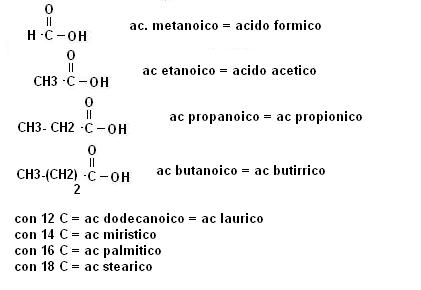
Nomenclatura
La nomenclatura IUPAC degli acidi carbossilici prevede l’uso del suffisso -oico.
Rimane tuttavia largamente utilizzata la vecchia nomenclatura.
Vediamo alcuni esempi:
Proprietà fisiche
Il gruppo carbossilico ha caratteristiche tipicamente polari ed è inoltre in grado di stabilire legami ad idrogeno intermolecolari.
Dal punto di vista delle proprietà fisiche quindi gli acidi carbossilici assomigliano molto agli alcool.
Gli acidi fino a 10 atomi di carbonio risultano liquidi, mentre quelli con un numero di atomi di carbonio superiore sono solidi.
Anche la solubilità in acqua decresce all’aumentare del numero di atomi di carbonio.
Reazioni degli acidi carbossilici
Gli acidi carbossilici possono dare diverse reazioni tra le quali citiamo:
1. reazioni di salificazione
2. reazioni di esterificazione
1) reazioni di salificazione
Come tutti gli acidi, gli acidi carbossilici, reagiscono con le basi formando dei sali.
Prendiamo ad esempio la reazione dell’acido acetico con l’idrossido di sodio:
CH3COOH + NaOH -> CH3COONa + H2O
Abbiamo detto che gli acidi carbossilici con un numero maggiore di 10 atomi di carbonio sono in genere solidi ed insolubili in acqua.
Quando salifichiamo questi composti otteniamo delle molecole di questo tipo:
CH3 – (CH2)n– COO–
queste molecole presentano una catena di atomi di carbonio [CH3 – (CH2)n-] insolubile in acqua, ma solubile nei grassi (sostanze apolari), ed un gruppo – COO– solubile in ambiente idrico.
I sali degli acidi grassi a numero maggiore di 10 atomi di carbonio sono i saponi.
I saponi consentono di emulsionare le sostanze grasse in acqua grazie proprio alla loro duplice caratteristica polare/non polare (la parte apolare si lega alle sostanze grasse, mentre quella polare all’acqua).
2) reazioni di esterificazione
Gli esteri sono molecole prodotte dalla reazione tra acidi carbossilici e alcool.
Immaginiamo di fare reagire l’acido acetico con l’alcool propilico ecco cosa si può formare:
Molti degli esteri ha più basso peso molecolare hanno odori gradevoli e sono presenti in molti frutti.
La reazione di esterificazione è una reazione di equilibrio, nel senso che gli esteri possono ritrasformarsi negli acidi e negli alcool originari.
La reazione contraria all’esterificazione prende il nome di idrolisi.
Tra gli esteri più presenti in natura troviamo gli esteri di un particolare alcool, la glicerina.
La glicerina possedendo tre gruppi OH può essere considerato un polialcool.
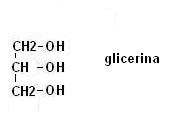
Ogni gruppo alcolico della glicerina può esterificare un acido carbossilico.
Gli esteri della glicerina vengono quindi chiamati trigliceridi e sono i principali costituenti della materia grassa presente in natura.
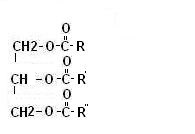
In genere gli acidi grassi uniti alla glicerina hanno un peso molecolare abbastanza alto, per cui dalla idrolisi della glicerina (che si opera in ambiente basico) otteniamo i sali degli acidi grassi che come abbiamo già visto sono i saponi.
Per produrre un sapone si opera quindi la idrolisi dei trigliceridi (grassi).
Questa reazione avviene facendo bollire la materia grassa con sostanze alcaline (idrossido di sodio o anche solo la cenere di legna).