Prendiamo in considerazione le seguenti tre sostanze
- S = zolfo elementare
- SO2= monossido di zolfo (anidride solforosa)
- SO3 = triossido di zolfo (anidride solforica)
Passando dallo zolfo all’anidride solforica le molecole presentano un numero crescente di atomi di ossigeno, in altre parole possiamo dire che lo zolfo nella molecola di anidride solforica risulta essere più ossidato.
L’ossigeno è un elemento del sesto gruppo (sei elettroni nell’ultimo livello energetico), che ha un elevato valore di elettronegatività (tendenza ad attirare a se degli elettroni).
Poichè la struttura più stabile tra gli elementi chimici è quella dei gas nobili (otto elettroni nell’ultimo livello), l’ossigeno avrà una certa tendenza ad acquistare 2 elettroni (da 6 a 8 elettroni).
Per questa ragione salvo rarissimi casi l’ossigeno presenta un numero di ossidazione di -2 (ricordarsi che gli elettroni hanno carica negativa).
Lo zolfo elementare come tutti gli elementi presenta numero di ossidazione = zero, se consideriamo -2 il numero di ossidazione dell’ossigeno potremo dire che
nel SO2 lo zolfo avrà numero di ossidazione +4 e
nel SO3 lo zolfo avrà numero di ossidazione +6.
In pratica passando da S a SO3 ha ceduto (perso) sei elettroni, che sono stati acquistati dall’ossigeno (2 elettroni per ogni atomo di ossigeno).
Nella reazione tra zolfo e ossigeno assistiamo quindi ad uno scambio di elettroni.
Sebbene il termine ossidazione abbia proprio origine da reazioni con l’ossigeno, oggi il termine di ossidazione si è esteso a tutta una serie di reazioni dove vengono scambiati degli elettroni.
Una sostanza si ossida quando perde degli elettroni.
Ma per fare perdere degli elettroni ad una sostanza occorre la presenza di un’altra sostanza che gli stessi elettroni gli acquista.
Una sostanza che acquista gli elettroni si dice che si riduce.
Cosi come nella teoria di Bronsted Lowry non esisteva un acido senza una base, così dobbiamo parlare di reazioni di ossidoriduzione in quando ad una sostanza che si ossida si accompagna sempre una sostanza che si riduce.
Al fine di ricordarsi chi perde e chi acquista gli elettroni possiamo utilizzare come acronimo la parola O.P.E.R.A
Ossidazione
Perdita
Elettroni
Riduzione
Acquisto
L’ossigeno non è l’unico elemento che abbia tendenza ad acquistare elettroni e quindi ad ossidare, per cui non è detto che in una reazione di ossidoriduzione debba comparire per forza questo elemento.
Calcolo del numero di ossidazione
Il numero di ossidazione rappresenta gli elettroni acquistati o ceduti in una molecola da parte di un elemento che la compone.
Uno stesso elemento può assumere diversi numeri di ossidazione a seconda della molecola in cui compare (vedi ad esempio lo zolfo nell’anidride solforica e solforosa).
Per determinare il numero di ossidazione di un elemento dobbiamo quindi utilizzare alcuni elementi che hanno numeri di ossidazione stabili, ecco alcune regole.
- Tutti gli elementi nativi (ad esempio Fe, Mg, O2, N2 etc) hanno numero di ossidazione zero
- Gli elementi del primo gruppo (H, Li, Na, K, Rb, Cs, Fr) quando sono presenti in molecole hanno praticamente sempre numero di ossidazione +1
- Gli elementi del primo gruppo (Ca, Mg, Sr, Ba) quando sono presenti in molecole hanno praticamente sempre numero di ossidazione +2
- L’ossigeno nelle molecole ha praticamente sempre numero di ossidazione -2
- Il fluoro nelle molecole ha sempre numero di ossidazione -1
Facciamo degli esempi
MgCl2 il magnesio è del secondo gruppo quindi numero di ossidazione +2 ne consegue che ogni atomo di cloro nella molecola avrà numero di ossidazione -1
H2SO4 l’ossigeno ha numero di ossidazione -2, essendoci 4 atomi di ossigeno avremo una carica di -8 (4 x -2), l’idrogeno vale +1 per cui essendoci due atomi di idrogeno avremo una carica positiva di +2 (+1 x 2).
Lo solfo varrà quindi +6, infatti +6 +2 -8 = 0
Nella tavola periodica vengono in genere riportati i numeri di ossidazioni possibili per ogni elemento.
Bilanciamento delle ossidoriduzioni
Ci sono diversi metodi per bilanciare le reazioni di ossidoriduzione, il metodo che prenderemo in considerazione ora è quello basato sul salto elettronico.
Consideriamo la seguente reazione da bilanciare
Fe + KMnO4 + H2SO4 -> FeSO4 + MnSO4 + K2SO4 +H2O
Le specie chimiche presenti sono: Fe, K, Mn, O, H
Stabiliamo i numeri di ossidazione delle specie chimiche prima e dopo
REAGENTI
Fe elemento nativo numero ossidazione = 0
KMnO4 molecola contenente:
- K primo gruppo numero di ossidazione = +1
- O numero di ossidazione = -2
- Mn lo ricaviamo per differenza: 4ossigeni x -2 = -8 1potassio x +1 = +1
-8 +1 + Mn = 0 Mn = +7
H2SO4 molecola contenente:
- H primo gruppo numero di ossidazione = +1
- O numero di ossidazione = -2
- S lo ricaviamo per differenza: 4ossigeni x -2 = -8 2potassio x +1 = +2
-8 +2 + S = 0 S = +6
PRODOTTI
FeSO4 molecola contenente:
- Ancora lo stesso gruppo S04—presente nella molecola di H2SO4 in cui lo zolfo valeva +6
- H primo gruppo numero di ossidazione = +1
- Fe lo ricaviamo per differenza: 4ossigeni x -2 = -8 1zolco x +6 = +6
-8 +6 +Fe = 0 Fe= +2
MnSO4molecola contenente:
- Ancora lo stesso gruppo S04—presente nella molecola di H2SO4 in cui lo zolfo valeva +6
- H primo gruppo numero di ossidazione = +1
- Mn lo ricaviamo per differenza: 4ossigeni x -2 = -8 1zolco x +6 = +6
-8 +6 +Mn = 0 Mn= +2
K2SO4 molecola contenente:
- Ancora lo stesso gruppo S04—presente nella molecola di H2SO4 in cui lo zolfo valeva +6
- K primo gruppo numero di ossidazione = +1
H2O molecola contenente:
- H primo gruppo numero di ossidazione = +1
- O numero di ossidazione = -2
Evidenziamo ora gli elementi che hanno modificato il loro numero di ossidazione.
|
Elemento |
nel reagente |
nel prodotto |
|
Ferro |
0 |
+2 |
|
Manganese |
+7 |
+2 |
|
Zolfo |
+6 |
+6 |
|
Ossigeno |
-2 |
-2 |
|
Idrogeno |
+1 |
+1 |
|
Potassio |
+1 |
+1 |
Il ferro aumenta il suo numero di ossidazione quindi si ossida, mentre il manganese diminuisce il suo numero di ossidazione quindi si riduce.
Un altro parametro da osservare è il numero di atomi con cui le specie chimiche interessate alla variazione dei numeri di ossidazione sono presenti nelle molecole dei reagenti e dei prodotti.
x il ferro: Fe FeSO4 abbiamo sempre un atomo quindi moltiplicatore = 1
x il manganese: KMnO4 MnSO4 abbiamo sempre un atomo quindi moltiplicatore = 1
NB sarebbe stato sufficiente che una molecola contenesse due atomi per avere un moltiplicatore = 2 (vedi prossimo esempio di reazione)
Ora facciamo il seguente schemino
|
elemento |
prima |
dopo |
salto |
moltiplicatore |
coefficiente da mettere |
|
ferro |
0 |
+2 |
=2 |
x1 |
= 2 |
|
manganese |
+7 |
+2 |
=5 |
x1 |
= 5 |
Incrociamo i coefficienti mettendo il 2 davanti alle molecole contenenti manganese ed il 5 davanti alle molecole contenenti ferro
5Fe + 2KMnO4 + H2SO4 -> 5FeSO4 +2MnSO4 + K2SO4 + H2O
Rimangono da mettere i coefficienti davanti all’ H2SO4 al K2SO4 ed all’acqua.
Come regola generale conviene tenere l’acqua come ultimo reagente contiamo quindi quanti atomi di potassio sono presenti nei reagenti
2KMnO4
ossia 2 molecole contenenti ciascuna un atomo per un totale di due atomi di K
nei reagenti dovremo mettere un 1 davanti al K2SO4 (il numero 1 viene sottointeso)
5Fe + 2KMnO4 + H2SO4 -> 5FeSO4 +2MnSO4 + K2SO4 + H2O
Per stabilire il numero di molecole di H2SO4 contiamo gli atomi di zolfo nei prodotti che danno come risultato il numero di 8 ( 5FeSO4 +2MnSO4 +1K2SO4 ) , per cui
5Fe + 2KMnO4 + 8H2SO4 -> 5FeSO4 +2MnSO4 + K2SO4 + H2O
Non ci resta che contare gli idrogeni per terminare il nostro lavoro
5Fe + 2KMnO4 + 8H2SO4 -> 5FeSO4 +2MnSO4 + K2SO4 + 8H2O
La reazione è così bilanciata.
Facciamo un altro esempio di reazione:
KMnO4 + HCl -> KCl + MnCl2 +Cl2 + H2O
dopo aver determinato i numeri di ossidazione osserviamo che:
- Il Mn passa da numero di ossidazione +7 (nel KMnO4) a +2 (nel MnCl2)
- il Cl passa da -1 (nel HCl) a 0 nel Cl2. NB solo una parte del Cl subisce la ossidoriduzione il numero di ossidazione del Cl nel KCl e nel MnCl2 rimane sempre a -1
Costruiamo la tabella
|
elemento |
prima |
dopo |
salto |
moltiplicatore |
coefficiente da mettere |
|
cloro |
-1 |
0 |
=1 |
x2 (due atomi di Cl nel Cl2) |
= 2 |
|
manganese |
+7 |
+2 |
=5 |
x1 |
= 5 |
A questo punto dovremo mettere il 5 davanti alle molecole contenenti Cl ed il 2 davanti alle molecole contenenti Mn, ma dobbiamo fare attenzione.
I coefficienti vanno, infatti, messi solo davanti alle molecole che effettivamente e completamente sono interessate alla ossidoriduzione.
Il manganese effettivamente è presente nella reazione solo in molecole in cui è variato il numero di ossidazione quindi possiamo mettere davanti ad esse il coefficiente di 2.
2KMnO4 + HCl -> KCl + 2MnCl2 +Cl2 + H2O
Il discorso è diverso per quanto riguarda il cloro, nelle molecole di KCl e di MnCl2 il numero di ossidazione non è variato e quindi non entrano nel meccanismo di scambio.
Dell’HCl solo una parte ha effettivamente reagito trasformandosi in Cl2 quindi il coefficiente che dovrà essere messo davanti a questa molecola dovrà essere maggiore di quello determinato dallo scambio di elettroni.
L’unica molecola contenente cloro in cui questo elemento ha modificato in esclusiva il numero di ossidazione e quella di Cl2 e solo davanti ad essa andrà messo il coefficiente 5.
2KMnO4 + HCl -> KCl + 2MnCl2 +5Cl2 + H2O
Per completare il bilanciamento possiamo vedere che l’ultima molecola non sistemata contenente K è il KCl, essendoci 2 K nei reagenti dovremo mettere un 2 davanti al KCl.
2KMnO4 + HCl -> 2 KCl + 2MnCl2 +5Cl2 + H2O
Adesso è possibile contare il numero complessivo di atomi di Cl presenti nei prodotti (16), dovremo perciò mettere un 16 davanti alla molecola di HCl.
2KMnO4 + 16HCl -> 2 KCl + 2MnCl2 +5Cl2 + H2O
Rimane da bilanciare l’acqua per terminare il nostro lavoro
2KMnO4 + 16HCl -> 2 KCl + 2MnCl2 +5Cl2 + 8H2O
Il potenziale delle ossidoriduzioni
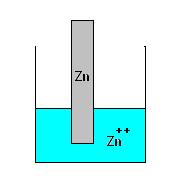
Supponiamo di mettere una lamina di un metallo (ad esempio Zinco) in una soluzione contenente un suo sale (e quindi ioni Zn++).
Lo zinco metallico avrà una certa tendenza a passere in soluzione e lo zinco in soluzione avrà una certa tendenza a depositarsi sulla lamina metallica.
Si raggiungerà quindi la seguente situazione di equilibrio:
Zn+++ 2e– <-> Zn
Più questo equilibrio è spostato verso destra maggiore sarà la tendenza dello zinco a ridursi (acquistare elettroni).
Possiamo valutare lo spostamento verso destra analizzando la costante di equilibrio che potremmo esprimere in questi termini.
Keq = [Zn] / [Zn++] [e–]2
Di queste specie chimiche solo la concentrazione di Zn++ esprime una specie chimica in soluzione, ed ha veri effetti sulla costante di equilibrio (vedi UD relativa agli equilibri eterogenei).
Possiamo quindi dire che la tendenza alla riduzione sarà funzione della concentrazione degli ioni Zn++ presenti in soluzione e sarà costante a temperatura costante (vedi influenza della temperatura sulla costante di equilibrio).
Un sistema costituito come dalla figura sopra riportata non consente però nessuna misurazione pratica in quanto come abbiamo accennato se una specie chimica perde elettroni un’ altra li deve acquistare.
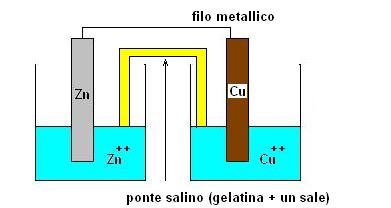
Per risolvere questo problema aggiungiamo un altro elemento al nostro sistema, ad esempio una lamina di rame in una soluzione contenente un suo sale come da figura sottostante.
Il ponte salino serve a chiudere il circuito senza far mescolare le due soluzioni.
Ora ci troviamo di fronte a due elementi (zinco e rame) che possono avere differenti tendenze ad ossidarsi o a ridursi.
Possiamo quindi scrivere i seguenti due equilibri.
Zn+++ 2e– <-> Zn
Cu+++ 2e– <-> Cu
Per evitare l’influenza della concentrazione sugli equilibri possiamo utilizzare entrambe le soluzioni saline uno molari ([Zn++] = [Cu++] = 1M) e per evitare l’influenza della temperatura immaginiamo di lavorare ad una temperatura costante (ad esempio 20°C)
Immaginiamo ora che il rame abbia maggiore tendenza a ridursi di quanto la abbia lo zinco, quello che osserveremo sarà:
Il rame si riduce secondo la seguente reazione
Cu+++ 2e– <-> Cu
osserveremo perciò che si forma del rame metallico sulla lamina di rame.
Per questa reazione occorrono però degli elettroni che vengono forniti dalla lamina di zinco che si ossida secondo la seguente reazione:
Zn <-> Zn+++ 2e–
osserveremo perciò che la lamina di zinco si corrode.
Gli elettroni circoleranno perciò dalla lamina di zinco a quella di rame passando attraverso il filo metallico.
Quando gli elettroni passano su un conduttore otteniamo della corrente elettrica.
Abbiamo quindi prodotto della corrente elettrica sfruttando la spontaneità di una reazione chimica.
Il dispositivo che abbiamo costruito è una pila.
Poichè gli elettroni (negativi) si muovono verso la lamina di rame (dove avviene la riduzione) questa assumerà segno positivo (il segno negativo è sulla lamina di zinco).
Il sito dove avviene la riduzione si chiama CATODO, quello dove avviene l’ossidazione l’ANODO.
In una pila quindi il catodo è positivo, mentre l’anodo è negativo.
Il passaggio della corrente è legato alla instaurazione di una differenza di potenziale tra la lamina di rame e quella di zinco.
Possiamo immaginare una differenza di potenziale come l’altezza di una cascata.
Se mettiamo uno strumento (voltmetro) sul filo di metallo che unisce le due lamine di rame e zinco leggeremo un valore di circa 1 volt.
Deduciamo che il potenziale di riduzione (ossia la tendenza a ridursi) del rame è maggiore di circa una unità rispetto a quella dello zinco.
La costruzione di una pila consente quindi una misurazione di confronto per stabilire quale tra due elementi sia più ossidante o riducente.
Siamo ora nelle condizioni di avere uno strumento che ci consente di costruire una scala per la misurazione della tendenza alla riduzione, quello che ci manca è solo un valore di riferimento per la nostra scala.
Facciamo un esempio, se io ho una cascata il cui dislivello è di 100 m, non ho nessuna informazione sulla quota assoluta dei punti di riferimento di questa cascata.
Il dirupo potrebbe essere tra 1100 e 1000 m di altitudine, tra 150 e 50 m di altitudine o a qualunque altra altezza.
Per stabilirà l’altitudine l’uomo ha considerato come riferimento il livello del mare a cui arbitrariamente ha assegnato un valore di zero (al posto del livello del mare si poteva usare un altro riferimento ad esempio il fondo della fossa delle Marianne).
Quello che ci manca quindi per la nostra scala della tendenza alla riduzione è un “livello zero”.
Si è quindi preso un elemento costituente la pila e si è detto questo elemento vale zero.
Abbinando questo elemento con un altro il valore di differenza di potenziale misurato rappresenta il valore dell’elemento in fase di misurazione (come se avessimo una cascata la cui acqua finisce nel mare, l’altezza della cascata corrisponde anche alla altimetria del suo punto superiore).
Un elemento di una pila si chiama elettrodo (o semielemento visto che ne servono due per fare una pila).
L’elemento di riferimento a cui è stato attribuito valore zero è l’elettrodo ad idrogeno rappresentato dalla seguente reazione:
2H+ + 2e– <-> H2
Confrontando questo semielemento con altri è stato possibile ottenere la seguente tabella.
| Semireazioni | potenziale | Semireazioni | potenziale | |
| Li+ + e– → Li | -3,05 | Sb+++ + 3e- → Sb | 0,1 | |
| K+ + e– → K | -2,93 | S++++ + 4e– → Sn | 0,15 | |
| Cs+ + e– → Cs | -2,92 | Cu++ + e– → Cu+ | 0,16 | |
| Ca++ + 2e– → Ca | -2,87 | Cu++ + 2e– → Cu | 0,34 | |
| Na+ + e– → Na | -2,71 | O2 + 2H2O + 4e– → 4OH– | 0,4 | |
| Mg++ + 2e– → Mg | -2,37 | Cu+ + e– → Cu | 0,52 | |
| Al+++ + 3e– → Al | -1,66 | l2 + 2e– → 2I– | 0,54 | |
| Mn++ + 2e– → Mn | -1,18 | MnO4–+ 2 H2O + 3e– → MnO2 + 4 OH– | 0,59 | |
| Zn++ + 2e– → Zn | -0,76 | CIO3– + 3 H2O + 6e– → CI– + 6 OH– | 0,62 | |
| Cr+++ + 3e– → Cr | -0,74 | Fe++ + e– → Fe+ | 0,77 | |
| Fe++ + 2e– →Fe | -0,44 | Ag+ + e– → Ag | 0,8 | |
| Cd++ + 2e– → Cd | -0,4 | Pb++++ + 4e– → Pb | 0,8 | |
| Co++ + 2e– → Co | -0,28 | Pd++ + 2e– →4 Pd | 0,82 | |
| H3PO4 + 2 H+ + 2e– → H3PO3 + H2O | -0,28 | Hg++ + 2e– → Hg | 0,86 | |
| Ni++ + 2e– →Ni | -0,25 | Pt+++++ 4e– → Pt | 0,86 | |
| Sn++ + 2e– → Sn | -0,14 | 2 Hg++ + 2e– → Hg2++ | 0,91 | |
| Pb++ + 2e– → Pb | -0,13 | CIO– + H2O + 2e– → CI– + 2 OH– | 0,94 | |
| Fe+++ + 3e– →Fe | -0,05 | NO3– + 4 H+ + 3e– → NO + 2 H2O | 0,96 | |
| 2 H+ + 2e– → H2 | 0 | Br2 + 2e– →2 Br | 1,07 | |
| O2 + 4H+ + 4e– →2H2O | 1,23 | |||
| MnO2 + 4 H+ + 2e– → Mn++ + 2 H2O | 1,23 | |||
| Cr2O7– – +14H+ + 6e– →2Cr+++ + 7 H2O | 1,33 | |||
| Cl2 + 2e– →2Cl– | 1,36 | |||
| Au+++ + 3e– → Au | 1,5 | |||
| PbO2 + 4 H+ + 2e– → Pb++ + 2 H2O | 1,45 | |||
| MnO4– + 8H+ + 5e– →Mn++ + 4 H2O | 1,51 | |||
| H2O2 + 2H+ + 2e– → 2H2O | 1,77 | |||
| Co+++ + e– → Co++ | 1,84 | |||
| S2O8– –+2e– →2SO4– – | 2,01 | |||
| F2 + 2e– → 2 F– | 2,87 |
Attraverso l’ausilio della tabella dei potenziali elettrochimici possiamo prevedere la spontaneità delle reazioni di ossidoriduzione, facciamo degli esempi:
Supponiamo di avere due becher contenenti del rame e dello zinco aggiungere dell’acido cloridrico e prevedere quale dei due metalli reagisce.
Iniziamo a considerare che l’acido cloridrico HCl, in soluzione libera ioni H+ e Cl–.
Le specie chimiche presenti saranno quindi:
Cu, Zn, H+, Cl–
Prendiamo in esame le semireazioni che contengono questi ioni
1. Cl2 + 2e– →2Cl– +1,36
2. Cu++ + 2e– → Cu +0,34
3. 2 H+ + 2e– → H2 0,00
4. Zn++ + 2e– → Zn -0,76 in rosso sono segnalate le specie presenti
Poichè i potenziali indicano il senso della riduzione (da sinistra a destra) non essendoci nessuna specie chimica che ha potenziale maggiore di +1,36 lo ione Cl– non avrà nessuna possibilità di ossidarsi a Cl2 .
Analogo discorso per il rame metallico che non può essere ossidato da nessuna delle specie chimiche presenti.
Gli ioni H+ si trovano ad avere un potenziale maggiore dello zinco (ed inferiore a quello del rame) per cui potranno ossidare lo Zn a Zn++.
Scriviamo quindi la semireazione dell’ H+ nel senso della riduzione e quella dello zinco nel senso della ossidazione.
2 H+ + 2e– → H2
Zn → Zn++ + 2e–
Gli elettroni persi dallo zinco sono nello stesso numero di quelli acquistati dall’idrogeno possiamo sommare le due semireazioni trovando
2 H+ + 2e– + Zn → H2 + Zn++ + 2e– annullando gli elettroni uguali a sinistra e destra avremo:
2 H+ + Zn → H2 + Zn++
Tra rame e zinco con l’acido cloridrico reagirà solo lo zinco in quanto il rame si trova ad avere un potenziale elettrochimico maggiore di quello della semireazione 2 H+ + 2e– → H2.
N.B nella tavola dei potenziali troviamo che l’oro, l’argento e il rame hanno potenziali maggiori di zero (quindi non si sciolgono nell’acido cloridrico) , non è quindi un caso che questi elementi vengono definiti “nobili”.
Attraverso l’uso della tabella dei potenziali abbiamo un altro metodo per bilanciare le reazioni.
Facciamo un esempio
Prendiamo due semireazioni
MnO4– + 8H+ + 5e– → Mn++ + 4 H2O +1,51
Br2 + 2e– → 2 Br +1,07
La prima semireazione ha un potenziale maggiore quindi va scritta nel senso della riduzione, mentre la seconda andrà scritta nel senso della ossidazione
MnO4– + 8H+ + 5e– →Mn++ + 4 H2O
2 Br → Br2 + 2e–
poiché il numero di elettroni scambiati devono essere uguali facciamo il minimo comune multiplo tra 5 e 2, dovremo perciò moltiplicare tutti i termini della prima semireazione per 2 e tutti i termini della seconda semireazione per 5.
2x (MnO4– + 8H+ + 5e– →Mn++ + 4 H2O)
5x (2 Br →Br2 + 2e– )
otterremo
2MnO4– + 16H+ + 10e– →2Mn++ + 8 H2O
10 Br →5Br2 + 10e–
trascriviamo tutti i termini a sinistra della freccia e quelli a destra della freccia semplificando gli elettroni che sono uguali, avremo:
2MnO4– + 16H+ + 10Br →2Mn++ + 8 H2O + 5Br2
Che non è altro che la reazione in forma ionica bilanciata.
L’elettrolisi.
Abbiamo visto come sfruttando la spontaneità delle reazioni di ossidoriduzione sia possibile costruire delle pile e quindi ottenere dell’energia.
In pratica quello che facciamo non è altro che sfruttare il DG negativo di una reazione (vedi capitolo dedicato all’energia libera) per ottenere del lavoro.
Nulla ci vieta però di valutare un processo non spontaneo ed immaginare cosa possa succedere se forniamo dall’esterno dell’energia (ad esempio dell’energia elettrica).
Immaginiamo ad esempio di avere dell’acqua distillata, essa si dissocia in H+ e OH– secondo il seguente equilibrio:
H2O <-> H+ + OH–
Immergiamo ora all’interno di un becker contenente acqua distillata due elettrodi collegati ad una pila.
Avremo un elettrodo positivo che attirerà gli ioni OH–, ed un elettrodo negativo che attirerà gli ioni H+.
Sull’elettrodo positivo avverrà la seguente reazione di ossidazione
4OH– → O2 + 2H2O + 4e– (sviluppo di ossigeno)
Sull’elettrodo negativo avverrà la seguente reazione di riduzione
2 H+ + 2e– → H2 (sviluppo di idrogeno)
Bilanciando gli elettroni scambiati la reazione globale sarà
4OH– +4 H+ → O2 + 2H2O + 2H2
Se prendiamo in considerazione i valori del potenziale di riduzione possiamo notare che questa reazione non è spontanea infatti:
2 H+ + 2e– → H2 0,00 potenziale inferiore va scritta nel senso opposto
O2 + 2H2O + 4e– → 4OH– +0,40 potenziale maggiore va scritta in questo senso
reazione spontanea O2 + 2H2O + 2H2 → 4OH– +4 H+
In altre parole fornendo energia elettrica al sistema siamo riusciti a far avvenire una reazione non spontanea.
Come elettrolisi intendiamo quel fenomeno per cui fornendo energia ad un sistema possiamo far avvenire delle reazioni di ossidoriduzioni non spontanee.
E’ da evidenziare che nel polo positivo di una cella elettrolitica (sistema dove avviene l’elettrolisi) si manifesta una ossidazione, mentre nel polo negativo una ossidazione.
Nelle celle elettrolitiche quindi l’anodo (sito ossidazione) è positivo, mentre il catodo è negativo.
La polarità dell’anodo e del catodo è quindi inversa rispetto a quella delle pile.