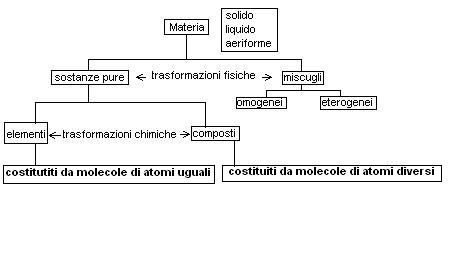
Nelle unità precedenti abbiamo stabilito come una sostanza pura possa essere un elemento o un composto e come sia possibile scomporre un composto negli elementi costituenti esclusivamente attraverso delle trasformazioni chimiche.
Supponiamo ora di avere una certa massa di un composto, ad esempio di acqua e di incominciare a dividere questa quantità in quantità via via più piccole.
Teoricamente arriveremo ad ottenere una singola particella di acqua che mantiene ancora le proprietà chimico-fisiche dell’acqua stessa, se operassimo una suddivisione ulteriore non avremmo più acqua, ma qualcosa di diverso (suddivisione del composto in elementi).
La più piccola particella di un composto che mantiene ancora le proprietà chimiche del composto in questione viene chiamata molecola.
Lo stesso ragionamento fatto con il composto potremmo ripeterlo con un elemento in questo caso la più piccola particella che mantiene le proprietà chimiche dell’elemento sarà chiamata atomo.
Taluni elementi come ad esempio l’idrogeno, l’ossigeno, l’azoto e altri si trovano in natura sottoforma di molecole costituite da due elementi uguali.
In definitiva dovremmo quindi definire la molecola come le più piccole particelle costituite da atomi uguali nel caso di elementi e da atomi diversi nel caso dei composti che mantengono ancora le proprietà chimiche della sostanza in questione.
Ma come è fatto un atomo?
Ipotesi sulla struttura dell’atomo
Se strofiniamo una bacchetta di plastica su di un panno e l’avviciniamo ad un filo di acqua che scende da un rubinetto vediamo come l’acqua venga deviata dal suo flusso rettilineo.
Questa deviazione denota che la materia può essere elettrizzata e la causa di questo fenomeno è dovuta al fatto che nell’atomo sono presenti delle cariche positive e delle cariche negative.
Le particelle positive vengono chiamate PROTONI, mentre le cariche negative ELETTRONI.
Sono state inoltre scoperte delle particelle presenti nell’atomo prive di carica elettrica, tali particelle vengono denominate NEUTRONI.
Attraverso osservazioni sperimentali si è messo in evidenza come i neutroni ed i protoni hanno una massa pressoché analoga e circa 1860 volte superiore a quella degli elettroni.
Una delle prime teorie su come è fatto l’atomo è stata sviluppata verso la fine del ‘800 da uno scienziato chiamato THOMPSON.
Thompson immaginò l’atomo come una struttura “piena” in cui i protoni e gli elettroni coesistevano e si neutralizzavano vicendevolmente.
Possiamo pensare l’atomo di Thompson come una sorta di panettone in cui al posto dell’uvetta e dei canditi troviamo i protoni e gli elettroni.
Questa visione dell’atomo “pieno” è stata messa in crisi da un esperimento svolto da uno scienziato di nome Rutherford intorno al 1910.
Rutherford bombardò con delle particelle a (particelle aventi massa e carica positiva) contro una sottile lamina d’oro.
Rutherford osservò che solo una piccolissima frazione delle particelle sparate veniva deviata, una frazione ancora più piccola rimbalzava, mentre la maggior parte di queste particelle attraversava la lamina indisturbata.
Attraverso questo esperimento si comprese che l’atomo è essenzialmente vuoto e che la massa dell’atomo è concentrata in una piccolissima zona che venne chiamata nucleo.
Nel nucleo sono quindi concentrati i neutroni ed i protoni (particelle aventi massa sensibile), mentre Rutherford ipotizzò che gli elettroni (neutralizzanti la carica positiva dei protoni del nucleo) si muovessero come dei pianeti intorno al sole su delle orbite circondanti il nucleo.
L’ipotesi dell’atomo “planetario” di Rutherford aveva però dei problemi in quanto non riusciva ad interpretare alcuni fenomeni sperimentali.
In particolare non riusciva a spiegare come mai nonostante in talune circostanze gli atomi potessero emettere dell’energia senza che gli elettroni cadessero nel nucleo.
La terra infatti ruota da millenni intorno al sole in quanto la sua velocità (legata alla energia cinetica) non viene rallentata nella sua orbita nello spazio.
Se dissipasse energia nel suo movimento (ad esempio per attrito) dovrebbe per forza rallentare e finirebbe per “cadere” nel sole.
Quello che si osservava sperimentalmente era che gli elettroni degli atomi in talune circostanze potevano cedere energia e nonostante questo non cadevano nel nucleo.
Per ovviare a questo difetto della teoria di Rutherford nel 1913 uno scienziato danese Niels Bohr ideò un nuovo modello atomico.
Questo modello teneva conto delle contemporanee scoperte e teorie sviluppate in quegli anni in particolare agli studi sulla meccanica quantistica e la natura dualistica della luce.
Secondo Bohr in un atomo gli elettroni ruotano in orbite o livelli stazionari, fin tanto che gli elettroni rimangono in dette orbite non perdono e non acquistano energia.
Se forniamo degli opportuni valori di energia ad un atomo i suoi elettroni possono passare da un livello ad un livello superiore.
L’energia acquistata per “promuovere” un elettrone ad un livello superiore viene poi restituita all’ambiente quando l’elettrone torna al suo livello stazionario.
Questa teoria concordava piuttosto bene con le osservazioni sperimentali e con la teoria quantistica di Plank.
Secondo questa teoria un atomo non poteva acquistare o cedere un qualsiasi valore di energia, ma solo determinati pacchetti di energia (denominati quanti).
Questa teoria con l’ipotesi di Bohr diventa facilmente interpretabile.
Immaginiamo ad esempio di trovarci in un edificio a più piani, dovendoci muovere tra un piano e l’altro con un ascensore non potremo fornire all’ascensore una energia arbitraria, ma solo l’esatto valore energetico legato alla differenza di livelli.
Un atomo quindi avendo un certo numero di elettroni posti in determinati livelli, può assorbire e quindi cedere solo determinati valori di energia.
Questa osservazione è alla base di una tecnica analitica chiamata spettrofotometria.
La luce è una forma di energia, alcuni atomi opportunamente eccitati riemettono parte della energia assorbita sottoforma di radiazioni luminose.
Poichè queste radiazioni dipendono dalla struttura elettronica dell’atomo stesso analizzando la lunghezza d’onda delle radiazioni emesse (spettro elettromagnetico) possiamo risalire alla natura dell’atomo in questione.
In seguito il concetto di orbita dell’elettrone intorno all’atomo venne esteso nel concetto di ORBITALE.
Come ORBITALE intendiamo la regione dello spazio in cui è massima la probabilità di trovare l’elettrone.
In pratica non dobbiamo più pensare ad un elettrone come una particella che si muove su una traiettoria circolare, ma piuttosto come un qualcosa che si muove all’interno di un volume.
Si è in effetti immaginato che l’elettrone abbia una natura dualistica, nel senso che può comportarsi sia come particella solida che come onda elettromagnetica, inoltre si ritiene che sia impossibile localizzare esattamente dove sia l’elettrone in quanto non è possibile per esso determinare nello stesso istante la sua posizione e la sua velocità (principio di indeterminazione di Heisemberg).
Vediamo allora di riassumere come si ritiene sia costituito un atomo.
In un atomo troviamo un nucleo centrale carico positivamente, costituito da protoni e neutroni.
Il peso dell’atomo è legato al numero di protoni e neutroni presenti.
Attorno al nucleo ci sono gli elettroni che si muovono all’interno di orbitali.
Nelle sue prime ipotesi Bohr considerava questi orbitali come sfere di diametro via via crescente, oggi sappiamo che la forma degli orbitali non è sempre sferica, ma di questo parleremo più avanti.
Definiamo NUMERO ATOMICO il numero di protoni presenti nell’atomo (di norma uguale al numero di elettroni).
Definiamo NUMERO DI MASSA la somma dei protoni e dei neutroni presenti nell’atomo.
Il potenziale di ionizzazione e le proprietà periodiche
Abbiamo detto che fornendo energia ad un elettrone questo può passare da un orbitale interno ad un orbitale più lontano dal nucleo.
Se la quantità di energia risulta sufficiente potremo arrivare a strappare un elettrone da un atomo secondo la seguente trasformazione:
Atomo + energia -> Atomo+ + elettrone –
L’atomo caricato positivamente prende il nome di ione e l’energia che dobbiamo fornire per strappare l’elettrone al nucleo prende il nome di potenziale di ionizzazione.
Per essere più precisi se consideriamo l’energia necessaria per staccare un elettrone parleremo di potenziale di prima ionizzazione, se consideriamo l’energia necessaria per staccare due elettroni all’atomo parleremo di potenziale di seconda ionizzazione e così via.
Se prendiamo gli elementi in relazione al loro numero atomico e misuriamo i potenziali di prima ionizzazione otteniamo un grafico simile al seguente:
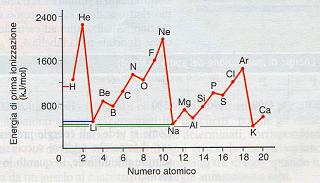
Notiamo che il grafico ciclicamente raggiunge dei valori minimi di energia.
Elementi come Idrogeno(H), litio(Li), sodio(Na) e potassio(K) hanno bassi valori di energia di ionizzazione, mentre He, Ne, Ar hanno alti valori di energia di ionizzazione.
Un’altra cosa che si osserva è che se prendiamo in considerazione gli elementi che hanno un comportamento simile (ad esempio idrogeno. litio, sodio e potassio) all’aumentare del numero atomico l’energia di ionizzazione diminuisce.
Oggi quest’ultima considerazione ci sembra ovvia.
Mano mano che ci allontaniamo dal nucleo un elettrone sarà sempre meno attratto e risulterà quindi più facile staccarlo dall’atomo.
Alla fine del ‘800 tutto ciò non era così ovvio, quello che si sapeva era che alcuni elementi avevano proprietà chimiche similari.
Fu così che un fisico russo chiamato Mendeleev incominciò a raggruppare gli elementi che avevano caratteristiche similari in funzione del loro peso atomico e notò che ciclicamente si ripetevano proprietà chimiche similari (proprio come nel grafico del potenziale di ionizzazione).
Mendeleev notò che in taluni casi questa ciclicità aveva delle lacune, ma anziché ritenere non valida la sua ipotesi, immaginò che alcuni elementi non fossero stati ancora scoperti.
Mendeleev costruì la sua tavola periodica degli elementi lasciando dei buchi che vennero riempiti negli anni seguenti con le scoperte di nuovi tipi di atomi.
La tavola periodica che oggi usiamo è in pratica analoga a quella di Mendeleev senza più discontinuità e con l’unica differenza sostanziale che invece di essere messi in funzione del loro peso atomico gli elementi nelle moderne tavole periodiche sono inseriti in funzione del loro numero atomico.
I numeri quantici
Abbiamo visto come l’energia assorbita o ceduta da un atomo sia legata alla sua struttura elettronica.
Effettuando misurazioni sull’entità dell’energia assorbita o ceduta da un atomo possiamo in pratica valutarne la natura questo tipo di misurazioni sono alla base delle tecniche di analisi chiamate SPETTROFOTOMETRIA.
In precedenza abbiamo accennato come la luce sia una forma di energia, la luce che i nostri occhi percepisce è solo una limitata gamma dell’insieme totale delle radiazioni elettromagnetiche.
L’insieme totale delle radiazione prende il nome di SPETTRO ELETTROMAGNETICO.
Quando gettiamo un sasso nello stagno notiamo che si formano delle onde, la distanza tra due creste o due ventri dell’onda si chiama lunghezza d’onda e viene indicata con la lettera greca lambda (λ); se misuriamo in un secondo quante onde passano in un punto otteniamo la frequenza dell’onda, che viene indicata con la lettera greca ni (ν).
La frequenza è inversamente proporzionale alla lunghezza d’onda tramite la seguente relazione
ν = C /λ dove C = velocità della luce nel vuoto (valore costante).
L’energia di una radiazione elettromagnetica è a sua volta proporzionale alla frequenza per cui possiamo affermare:
- maggiore frequenza = minore lunghezza d’onda = maggiore energia
- minore frequenza = maggiore lunghezza d’onda = minore energia
Lo spettro elettromagnetico comprende sia radiazioni ad altissima frequenza (ed altissima energia) tipo i raggi gamma, sia radiazioni a bassa frequenza tipo le onde radio.
Di questo insieme solo le radiazioni comprese tra gli 800 ed i 400 nm sono percepite come luce visibile dai nostri occhi.
Sopra gli 800 nm troviamo gli infrarossi, mentre sotto i 400 nm gli ultravioletti.
Se scomponiamo la luce bianca con un prisma troviamo che essa è costituita da un insieme continuo di radiazioni visibili
Se invece osserviamo lo spettro visibile emesso o assorbito da un elemento chimico specifico troviamo che esso presenta delle ben isolate bande di assorbimento o di emissione.
Ad esempio l’idrogeno presenta il seguente spettro

Come si può notare le bande di assorbimento corrispondono praticamente alle bande di emissione.
Abbiamo infatti detto che un elettrone può acquistare solo l’energia sufficiente per saltare da un orbitale all’altro e questa energia viene poi restituita (quindi emessa) quando l’elettrone torna al suo livello stazionario.
Osservando gli spettri di assorbimento o di emissione si è potuto osservare che ci sono almeno 7 bande di assorbimento ben distinte.
Queste bande corrispondono a 7 livelli principali.
Bohr immaginava gli orbitali come sfere, per cui attribuì ad ogni sfera un numero, definito numero quantico principale (indicato con la lettera n) che corrispondeva alla dimensione (raggio) e quindi alla distanza massima dal nucleo dell’orbitale stesso.
Possiamo pensare il numero quantico principale n come in pratica l’indicatore dei piani di un ascensore, più è alto più siamo lontani dal piano terra.
L’ipotesi fatta però si scontrava con delle osservazioni sperimentali, alcuni elementi infatti presentavano un numero molto maggiore di 7 bande di assorbimento, vediamo ad esempio lo spettro visibile del mercurio.

Si è quindi ipotizzato che in ogni livello principale potessero coesistere diversi sottolivelli, come se in un piano di una abitazione sufficientemente alto venissero costruiti dei soppalchi.
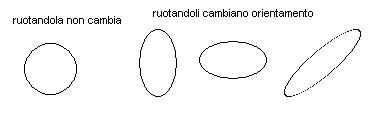
E’ possibile inoltre fare un’altra considerazione, se un orbitale è perfettamente sferico è sufficiente il raggio per determinarne la forma, ma se l’orbitale fosse ellittico occorrerebbero almeno due valori (raggio minimo e raggio massimo) per definirne la forma.
Più la forma dell’orbitale è complicata maggiore è il numero di parametri necessari per definirne la forma.
Si è quindi introdotto un numero quantico secondario (l), che possiamo associare alla forma dell’orbitale.
Il numero quantico secondario (l) non può assumere un valore qualsiasi, ma il suo valore è legato al numero quantico principale (n).
La relazione tra “n” e “l” è la seguente
l = 0 -> n-1 ossia “l” può assumere tutti i valori compresi tra 0 e n-1
facciamo un esempio
n l
1 0 un solo livello
2 0 e 1 due sottolivelli
3 0,1,2 tre sottolivelli
4 0,1,2,3 quattro sottolivelli
etc
Anche considerando il numero quantico secondario le righe di assorbimento o di emissione erano ancora in numero superiore a quelle previste, si è stato per tanto necessario introdurre un ulteriore numero quantico al quale è stato assegnato il seguente significato.
Quando una carica elettrica si muove genera un campo magnetico.
L’entità del campo magnetico generato dipende dalla direzione di movimento della carica.
Un orbitale orientato nello spazio in una certa direzione avrà quindi un campo magnetico diverso da quello di un orbitale avente stessa forma e dimensione ma orientato in un’altra direzione.
E’ da notare che una sfera non ha un orientamento specifico, mentre un ellissoide può essere orientato lungo i tre assi cartesiani.
Il terzo numero quantico, denominato numero quantico magnetico (m), è quindi associabile all’orientamento dell’orbitale nello spazio.
Anche questo numero quantico non può assumere valori arbitrari, ma solo valori legati al numero quantico secondario.
La relazione tra “l” e “m” è la seguente
m= -l a +l ossia “m” può assumere tutti i valori compresi tra +l e -l, come al solito facciamo un esempio:
n l m
1 0 0 un solo livello sferico
——————————————————
2 0 0 un solo livello sferico
1 -1,0,+1 tre sottolivelli orientati
——————————————————
3 0 0 un solo livello sferico
1 -1,0,+1 tre sottolivelli orientati
2 -2,-1,0,+1,+2 cinque sottolivelli forma complessa orientati
——————————————————
4 0 0 un solo livello sferico
1 -1,0,+1 tre sottolivelli orientati
2 -2,-1,0,+1,+2 cinque sottolivelli forma complessa orientati
3 -3,-2,-1,0,+1,+2,+3 sette sottolivelli forma complessa orientati
—————————————————–
etc
Si è infine dimostrato che in ogni orbitale possono coesistere al massimo due elettroni.
Poichè gli elettroni hanno carica negativa (quindi tenderebbero a respingersi), devono presentare una caratteristica diversa che gli permetta di condividere lo stesso orbitale.
Si è quindi introdotto un ultimo numero quantico denominato SPIN (dall’inglese rotazione) che può essere collegato al senso di rotazione dell’elettrone o dell’onda ad esso associato.
In un orbitale possono quindi stare al massimo due elettroni con spin opposto.
Se un elettrone ha spin +1/2,
l’altro elettrone dello stesso orbitale avrà spin=-1/2.
E’ interessante notare come ai numeri quantici si sia arrivati sia seguendo la teoria meccanico quantistica di Bohr, sia seguendo il modello ondulatorio degli elettroni.
Nel 1926, infatti, il fisico Schrodinger elaborò una complicatissima equazione matematica.
Questa equazione consentiva di elaborare la regione dello spazio dove si localizzasse con maggiore probabilità un onda associata all’elettrone.
In pratica questa equazione ci consentiva di determinare la forma degli orbitali.
Per risolvere questa equazione occorrevano però definire delle variabili le quali non potevano assumere valori arbitrari.
Queste variabili erano proprio i numeri quantici.
I sottolivelli e la organizzazione della tavola periodica
Ora che conosciamo il significato dei numeri quantici possiamo valutare quanti elettroni possono stare in ogni sottolivello.
Riprendiamo la tabella già visionata:
n l m
1 0 0 sferico (s) due elettroni
totale 2 elettroni
——————————————————
2 0 0 sferico (s) due elettroni
1 -1,0,+1 a salsiccia (p) 6 elettroni (3×2)
totale 8 elettroni
——————————————————
3 0 0 sferico (s) due elettroni
1 -1,0,+1 a salsiccia (p) 6 elettroni (3×2)
2 -2,-1,0,+1,+2 forma complessa (d) 10 elettroni (5×2)
totale 18 elettroni
——————————————————
4 0 0 sferico (s) due elettroni
1 -1,0,+1 a salsiccia (p) 6 elettroni (3×2)
2 -2,-1,0,+1,+2 forma complessa (d) 10 elettroni (5×2)
3 -3,-2,-1,0,+1,+2,+3 forma complessa (f) 14 elettroni (7×2)
totale 32 elettroni
—————————————————–
etc
Prendiamo ora in visione una tavola periodica

Notiamo che in essa ci sono 7 righe, equivalenti ai sette valori del numero quantico principale “n”.
Nel primo periodo troviamo due elementi, idrogeno ed elio, ed infatti al numero quantico n = 1 corrisponde un massimo di due elettroni.
Nel secondo periodo troviamo 2+6=8 elementi (Li, Be, B, C, N, O, F e Ne) ed in effetti al numero quantico n=2 corrisponde un massimo di 8 elettroni.
Al terzo periodo troviamo ancora 8 elementi, mentre ce ne aspetteremmo 18.
Spiegheremo più avanti questa anomalia che si risolve se immaginiamo che i 10 elementi compresi tra Sc e Zn che troviamo nel quarto periodo siano in realtà riferiti al numero quantico principale n = 3
Mentre le linee orizzontali della tavola periodica si chiamano periodi, le linee verticali si chiamano gruppi.
Gli elementi dei gruppi I e II (a cui possiamo aggiungere l’elio che pur essendo nel gruppo VII è un caso particolare) hanno gli elettroni più esterni nell’orbitale a forma sferica “s”
Gli elementi dei gruppi III, IV, V, VI , VII, VIII (6 gruppi) hanno gli elettroni più esterni negli orbitali “p” (3 orbitali = 6 elettroni al massimo)
Gli elementi di transizione sono collocati in 10 gruppi come il numero massimo di elettroni che possono occupare gli orbitali di tipo “d” (5 orbitali = 10 elettroni al massimo)
Ed i lantanidi e gli attinidi sono collocati in 14 gruppi come il numero massimo di elettroni che possono occupare gli orbitali di tipo “f” (7 orbitali = 14 elettroni al massimo).
In definitiva iniziamo a capire che la forma particolare assunta dalla disposizione degli elementi nella tavola periodica non è casuale, ma è legata alla disposizione degli elettroni intorno all’atomo preso in considerazione.
L’ordine di riempimento degli orbitali e la struttura elettronica degli elementi
Abbiamo detto che ogni elemento chimico ha una specifica struttura elettronica, ossia ha gli elettroni collocati in determinati livelli stazionari.
Dobbiamo ora capire in che ordine vengono riempiti dagli elettroni gli orbitali.
——————————————————————
Facciamo un esempio consideriamo il carbonio n° atomico 6, questo elemento ha 6 protoni e quindi 6 elettroni da sistemare.
In quali orbitali vengono collocati questi 6 elettroni?
La logica da seguire è quella del minore dispendio energetico, mano mano che ci allontaniamo dal nucleo gli elettroni risultano meno attratti dai protoni e quindi meno stabili e più energetici.
I primi orbitali ad essere riempiti sono quelli più vicini al nucleo.
Il primo livello, n=1 ha un solo orbitale “s” capace di contenere 2 elettroni.
I primi due elettroni del carbonio saranno quindi collocati nell’orbitale 1s, e potremo scrivere:
1s2 (si legge due elettroni nell’orbitale 1s)
rimangono 4 elettroni da sistemare
Il secondo livello, n=2 ha un orbitale di tipo “s” (due elettroni) e tre orbitali di tipo “p” (sei elettroni).
due elettroni si metteranno nell’orbitale 2s, mentre gli altri due si metteranno in due orbitali p (ciascuno con un elettrone).
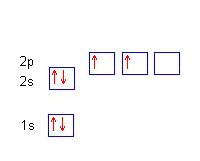
La struttura completa del carbonio sarà quindi:
1s2
2s2 2px1py1
questa situazione può essere rappresentata anche in questo modo:
——————————————————————
Potremmo immaginare quindi la logica della disposizione degli elettroni nell’atomo come quella che può guidare un albergatore nel riempire cercando di risparmiare il massimo possibile le stanze del suo albergo.
L’albergo ha un numero di stanze via via maggiore man mano che si sale di piano, ogni stanza può contenere due ospiti al massimo.
- Se l’albergatore si trova ad ospitare una sola persona non la mette all’ultimo piano (maggiori spese di ascensore e di riscaldamento essendo un piano più grande), ma lo mette nell’unica stanza del primo piano.
Struttura dell’idrogeno (un elettrone) 1s1
- Se arriva un altro ospite l’albergatore ha interesse a completare il primo piano piuttosto che aprire il piano superiore, il secondo elettrone viene quindi messo nella stessa “stanza”
Struttura dell’elio (due elettroni) 1s2
Con l’elio abbiamo completato il primo piano
- Il terzo ospite deve andare al secondo piano occupando la prima stanza disponibile, il litio avrà quindi struttura 1s2 2s1
- Il quarto ospite completerà la stanza principale del secondo piano, il berillio avrà quindi struttura 1s2 2s2
- Per il quinto ospite andremo ad aprire il soppalco del secondo piano che contiene le stanze p.
Ecco che il Boro avrà struttura 1s2 2s22p1
Si procede continuando a riempire le camere del soppalco con i 5 elementi successivi fino ad arrivare al Neon che avrà la seguente struttura
1s2 2s22p6 (con questo elemento abbiamo completato il secondo livello).
L’elemento con numero atomico 11 è il sodio, in questo atomo si inizierà a riempire l’orbitale 3s.
Il sodio avrà quindi la struttura del neon + un elettrone 3s1
Il discorso procede come per il secondo livello fino ad arrivare all’elemento Argon (Ar) che avrà una struttura
1s2 2s22p63s23p6
A questo punto dovremmo immaginare che l’elemento successivo (il potassio) metta l’elettrone in più nel sottolivello 3d, ma ciò non avviene.
Possiamo pensare, tornando all’esempio dell’albergo che poichè il soppalco 3d contiene 5 stanze abbia dei costi di gestione maggiori di quelli che ha la camera ad un unica stanza del piano 4s.
Il potassio avrà quindi struttura 1s2 2s22p63s23p64s1,
il calcio avrà struttura 1s2 2s22p63s23p64s2
e solo dallo Scandio (Sc) si inizieranno a riempire gli orbitali 3d lasciati vuoti.
Questo spiega l’anomalia segnalata nel paragrafo precedente per cui gli elementi che riempivano l’orbitali 3d venivano a trovarsi nel quarto periodo.
Il discorso procede con una logica analoga per tutti gli elementi, per seguire il riempimento degli orbitali possiamo utilizzare comodamente la seguente tabellina.
Per avere l’ordine di riempimento basta seguire le frecce, vediamo ad esempio che dopo l’orbitale 4s, si torna a riempire l’orbitale 3d (lasciato vuoto in precedenza), quindi il 4p, dopo di che si passa al 5s e così via.
Struttura elettronica e proprietà chimiche similari
Siamo ora in grado di capire abbastanza facilmente il motivo per cui gli elementi dello stesso gruppo della tavola periodica hanno proprietà chimiche similari.
Prendiamo in rassegna ad esempio gli elementi del primo gruppo e focalizziamo l’attenzione sulla struttura elettronica dell’ultimo livello energetico:
H 1s1
Li 2s1
Na 3s1
K 4s1
Rb 5s1
Cs 6s1
Fr 7s1
tutti questi elementi hanno un solo elettrone nell’ultimo orbitale, in pratica cioè hanno una struttura elettronica similare.
A struttura elettronica simile corrispondono delle proprietà chimiche simili.
Torniamo all’esempio del nostro albergatore, supponendo che esso debba tenere riscaldato un intero piano del suo albergo per una sola persona.
Questa persona gli diventa antieconomica e se possibile cercherà di allontanarla (magari chiedendogli di passare in un albergo a cui manca una persona per completare una stanza).
Appare quindi chiaro il motivo per il quale gli elementi del primo gruppo presentano un basso valore dell’energia di ionizzazione oltre ad altre proprietà chimiche simili.
Nella tavola periodica gli elementi di un gruppo hanno quindi la stessa struttura nell’ultimo orbitale, gli elementi dei primi due gruppi riempiono gli orbitali “s” dell’ultimo livello, gli elementi di transizione gli orbitali di tipo “d”, i lantanidi e gli attinidi gli orbitali di tipo “f” e gli elementi dei gruppi III,IV,V,VI,VII,VIII gli orbitali di tipo “p”.
A struttura elettronica simile corrispondono proprietà chimiche analoghe.
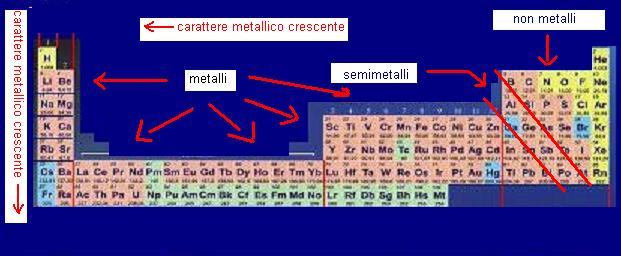
Nella tavola periodica gli elementi vengono anche classificati in metalli, non metalli e semimetalli.
Il carattere metallico di un elemento è legato alla tendenza a perdere gli elettroni.
Gli elementi del primo gruppo hanno maggiore tendenza a perdere gli elettroni di quelli del settimo gruppo.
Il carattere metallico quindi diminuisce spostandosi da sinistra a destra della tavola periodica.
Mano mano che il raggio atomico aumenta gli elettroni risentono di meno dell’attrazione del nucleo quindi il carattere metallico sale scendendo lungo i gruppi.
Ecco che i metalli si localizzeranno nella parte bassa sinistra della tavola periodica, mentre i non metalli nella parte alta destra della medesima tavola.
I semimetalli occuperanno una fascia diagonale di separazione tra metalli e non metalli.