vedi anche pagine libro: da 28 a 32
I carboidrati sono i composti che costituiscono la maggior parte dei tessuti vegetali.
La loro funzione dietologica principale è quella dell’apporto energetico.
Si tratta di molecole a peso molecolare variabile che variano da circa 200 Dalton fino a valori dell’ordine di 106.
Una analisi chimica elementare dei carboidrati porta ad ottenere una formula generale di questo tipo:
Cn(H2O)m (da cui il nome di carboidrati).
Si tratta perciò di molecole costituite da tre elementi: carbonio, idrogeno e ossigeno.
Studi successivi hanno evidenziato che in realtà i carboidrati con peso molecolare superiore non sono altro che polimeri di unità più semplici.
Si parla perciò di:
· monosaccaridi (unità monomeriche a basso peso molecolare)
· polisaccaridi (polimeri costituiti da unità di monosaccaridi)
I monosaccaridi
L’analisi dei monosaccaridi ha messo in evidenza che essi presentano:
· quasi tutti capacità di rotazione della luce polarizzata (otticamente attivi quindi hanno carboni chirali)
· dei gruppi alcoolici di cui almeno uno primario
· un gruppo carbonilico che può essere aldeidico o chetonico.
Si definiscono:
· aldosi i monosaccaridi contenenti un gruppo aldeidico
· chetosi i monosaccaridi contenenti un gruppo chetonico
· diosi i monosaccaridi con due atomi di carbonio
· triosi i monosaccaridi con tre atomi di carbonio
· tetrosi i monosaccaridi con quattro atomi di carbonio
· pentosi i monosaccaridi con cinque atomi di carbonio
· esosi i monosaccaridi con sei atomi di carbonio.
Ad esempio il glucosio è un aldoesoso, mentre il fruttosio un chetoesoso.
La presenza di carboni chirali da luogo nei monosaccaridi alla formazione di molteplici stereoisomeri.
Incrociando le informazioni note i chimici stabilirono per gli aldoesosi una formula di questo genere:
La presenza di 4 atomi di carbonio chirale origina 24= 16 stereoisomeri (8 coppie di enantiomeri)
Le 8 forme con l’OH del carbonio 5 messo verso destra sono quelle presenti in natura è vengono indicate con la lettera D prima del nome.
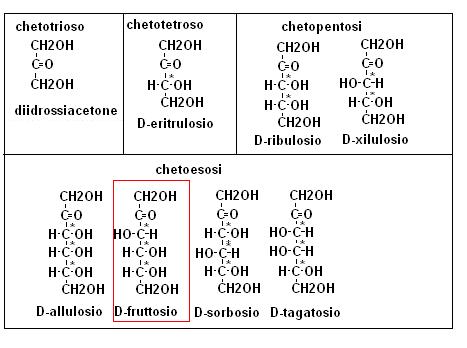
Lo stesso ragionamento lo potremo eseguire per gli aldopentosi, che originano 8 steroisomeri, (4 coppie di enantiomeri) le cui forme D, presenti in natura sono: xilosio, lixosio, arabinosio e ribosio, e per gli aldosi con numero ancora minore di atomi di carbonio.
Riportiamo i nomi e le formule nella seguente figura:
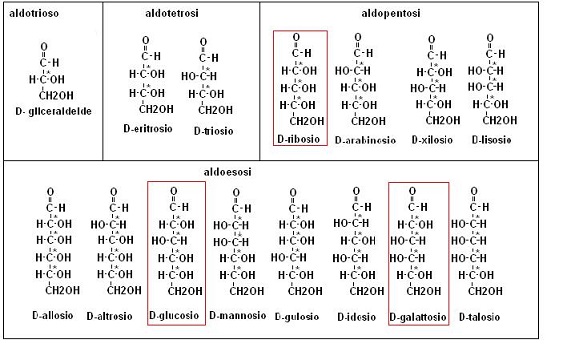
A complicare maggiormente il discorso, ricordiamo la presenza dei chetosi, quelli naturali presentano il gruppo carbonilico sul carbonio 2, tra i quali citiamo il fruttosio.
Dopo aver fatto questa carrellata sui diversi monosaccaridi presenti in natura, soffermiamoci sui più importanti che sono:
· glucosio (aldoesoso): è la sostanza organica più diffusa in natura, entra nella composizione di diversi polisaccaridi (amido, cellulosa, glicogeno) e di diversi disaccaridi ( lattosio, maltosio, saccarosio). Il suo potere dolcificante è circa la metà di quello del saccarosio.
· galattosio (aldoesoso): è il monosaccaride che insieme al glucosio entra nella composizione del lattosio.
· fruttosio (chetoesoso): è uno zucchero piuttosto diffuso in natura. Il suo potere dolcificante è maggiore di quello del saccarosio, ma essendo difficilmente cristallizzabile risulta poco commercializzabile
· ribosio (presente nel RNA): è il più diffuso tra i pentosi, il suo derivato desossiribosio (molecola di ribosio con un OH in meno) è il costituente del DNA.
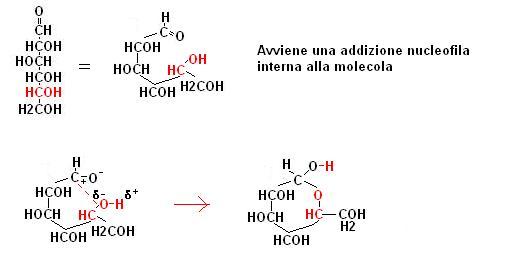
Nella unità didattica di seconda riguardante i gruppi funzionali, abbiamo illustrato come il gruppo alcoolico possa reagire con un gruppo carbonilico per dare un semiacetale.
Negli esosi il gruppo carbonilico attaccato al carbonio 1 si trova vicino al gruppo alcoolico attaccato al carbonio 5.
Quella che si viene a formare è quindi una reazione interna alla molecola che porta alla formazione di una struttura analoga alla seguente:
I monosaccaridi aldoesosi presentano quindi una struttura ad anello a 6 atomi (5 di carbonio + 1 di ossigeno).
La chiusura nei chetoesosi porta invece alla formazione di un anello a 5 atomi (4 di carbonio + 1 di ossigeno).
Gli zuccheri complessi, polisaccaridi, possono quindi essere immaginati come una sequenza di anelli a 6 (o 5 atomi) che si ripetono n volte.
La chiusura della molecola ad anello da luogo a due nuove problematiche:
· Provoca la formazione di un nuovo centro chirale sul carbonio 1 (quello che aveva il gruppo carbonilico
· fa nascere il problema di dover rappresentare la formula degli stereoisomeri.
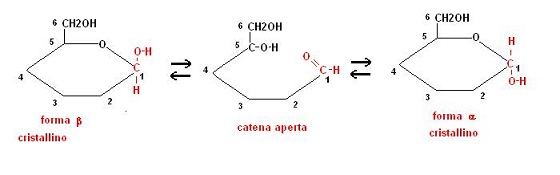
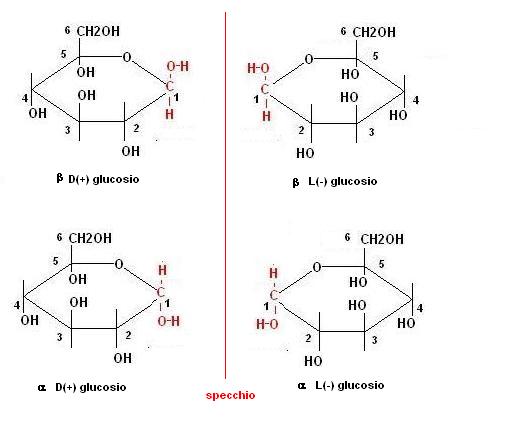
Per convenzione si è stabilito che i gruppi a destra della molecola lineare vengano messi sotto il piano della molecola ad anello e viceversa.
Lo stereoisomero che presenta il gruppo OH attaccato al carbonio 1 in alto viene indicato con la lettera b, mentre quello con il gruppo OH in basso con la lettera a .
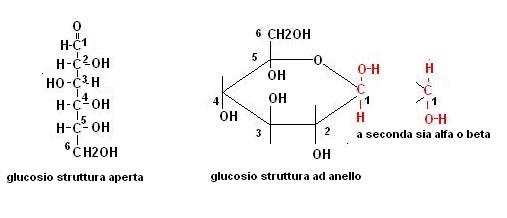
Tanto per fare un esempio saranno possibili 4 formule del glucosio:
NB. il carbonio C1 (quello in rosso) non è attaccato ad un normale gruppo alcolico, ma ad un gruppo carbonilico che ha dato una reazione nucleofila.
Poichè la forma a catena chiusa si trova in equilibrio con la formula a catena aperta è questo carbonio quello che consente al monosaccaride aldoso (per i chetosi il discorso va fatto sul carbonio C2) di dare le reazioni tipiche dei gruppi carbonilici.
I disaccaridi
Dall’unione di due monosaccaridi si ottiene un disaccaride.
Il legame che tiene unito due unità monosaccaridi prende il nome di legame glicosidico.
Il legame glicosidico avviene per unione di un OH proveniente da un monosaccaride con un OH proveniente dall’altro monosaccaride e conseguente perdita di acqua.
Se il monosaccaride è derivante da un aldoesoso in genere i legami glicosidici interessano gli ‘OH uniti al carbonio 1 e quelli legati al carbonio 4.
Facciamo degli esempi.
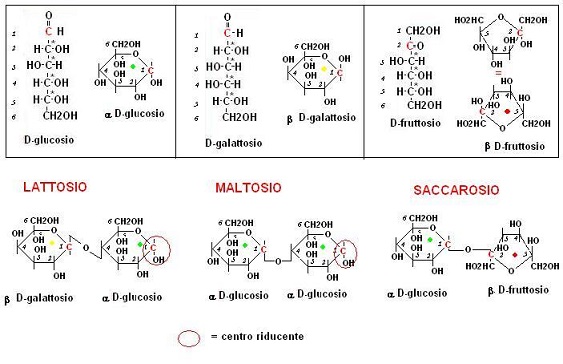
Il lattosio è un disaccaride formato dall’unione del galattosio con il glucosio che come vedremo costituisce fino al 5% del latte vaccino.
Tecnicamente il lattosio viene definito: 1b-4 galattopiranosil a glucopiranoside (il termine piran… deriva da pirano che è la molecola ciclica a 6 atomi contenente 5 carboni ed un ossigeno)
Il nome indica che il lattosio si ottiene attraverso la formazione di un legame glicosidico tra il carbonio 1 del b galattosio e il carbonio 4 dell’a glucosio
Come possiamo notare mentre il carbonio 1 (quello di natura carbonilica) del galattosio è impegnato nel legame glicosilico il carbonio 1 del glucosio rimane libero.
Il lattosio quindi mantiene alcune proprietà dei gruppi carbonilici ed in particolare quella di ridurre il reattivo di Fehling e quello di Tollens (vedi qui).
Gli zuccheri che hanno questa possibilità vengono chiamati zuccheri riducenti.
E’ da notare che la specificità degli enzimi digestivi è in grado di riconoscere i legami a da quelli b glucosidici.
Ad esempio la digestione del lattosio viene operata da enzimi b galattosidasi (lattasi).
Questi enzimi presenti nei lattanti, tendono a scomparire negli adulti (alcune persone ne sono addirittura prive) sopratutto se non abituati a consumare latte.
L’assenza degli enzimi lattasi è causa di fenomeni di intolleranza al latte.
Alcuni latti in commercio (tipo Zymil) vengono trattati a priori con soluzioni enzimatiche di lattasi al fine di convertire a priori il lattosio in galattosio e glucosio e quindi renderlo digeribile.
Il maltosio è un disaccaride formato da due unità di glucosio, rappresenta il disaccaride contenuto nella birra.
Tecnicamente il maltosio viene definito 1a-4 glucopiranosil a glucopiranoside.
Il nome indica che questo disaccaride si ottiene attraverso la formazione di un legame glicosidico tra il carbonio 1 e quello 4 di due unita di glucosio.
Anche il maltosio come il lattosio è uno zucchero riducente. Gli enzimi a glucosidici sono piuttosto frequenti nell’organismo (amilasi) per tanto il maltosio non da problemi di digestione.
Il saccarosio (zucchero da tavola) è il disaccaride formato da una unità di fruttosio e una di glucosio.
Tecnicamente si tratta del 1a-2 glucopiranosil b fruttofuranoside (furanosio = anello ciclico a 5 atomi contenente un ossigeno), si vengono ad unire quindi il carbonio 1 del glucosio (gruppo carbonilico) con il carbonio 2 del fruttosio (carbonilico).
Il saccarosio è quindi uno zucchero non riducente in quanto non presenta gruppi carbonilici liberi.
Il saccarosio possiede un angolo di rotazione della luce polarizzata positivo, quando viene scisso in glucosio e fruttosio l’angolo di rotazione si modifica e diventa negativo.
Per questo motivo gli enzimi che provocano la rottura del saccarosio prendono il nome di invertasi.
I polisaccaridi
Si tratta di polimeri costituiti da innumerevoli unità di monosaccaridi.
Il polisaccaride naturale più diffuso è l’amido che è costituito dalla ripetizione di unità di glucosio.
Le varie unità di glucosio nell’amido sono unite da legami alfa (in prevalenza 1a-4, come quelli del maltosio, con di tanto in tanto 1a-6 ramificanti la catena) che sono attaccabili dagli enzimi digestivi.
La cellulosa è un altro polisaccaride del glucosio, nel quale però le unità monomeriche sono unite da legami beta. Gli enzimi digestivi non riescono a idrolizzare i legami beta e questo spiega il motivo per cui gli esseri umani non digeriscono questo polisaccaride.
Gli erbivori presentano degli stomaci che contengono una flora microbica in grado di idrolizzare la cellulosa, è la simbiosi con questi microorganismi che rende digeribile la cellulosa a questi animali.
Nell’industria alimentare vengono utilizzati molti altri tipi di polisaccaridi alcuni dei quali estratti da alghe o da vegetali, è il caso degli alginati e carraginine (da alghe) e dei carrubani (dalle carrube).
Questi polisaccaridi hanno la caratteristica di formare gelatine ed agire da emulsionanti, per questi motivi vengono spesso utilizzati nell’industria dolciaria, specie per i gelati, al fine di rendere più cremosi diversi prodotti.