Nell’unità didattica precedente abbiamo visto quali sono i tre stati principali della materia (solido, liquido e aeriforme) e le loro principali caratteristiche.
Abbiamo anche stabilito che le sostanze pure possono essere costituite da elementi o da composti.
Immaginiamo ora di avere una sostanza pura e di poter vedere la sua struttura interna nei tre stati di aggregazione fondamentali.
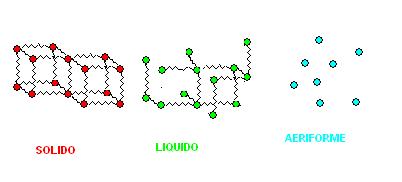
Tra le singole particelle possono svilupparsi delle interazioni.
Poichè queste interazioni interessano particelle diverse vengono definite interazioni INTERPARTICELLARI.
Possiamo immaginare queste interazioni come una sorta di molle.
Nei solidi queste interazioni sono molteplici, la struttura diventa rigida e mantiene una sua forma ed un suo volume, nei liquidi queste interazioni sono ridotte, mentre nei solidi sono assenti.
Appare abbastanza ovvio che per rompere queste interazioni sia necessario fornire dell’energia.
I passaggi di stato:
solido-> liquido,
liquido -> aeriforme,
solido-> aeriforme
Impongono che l’ambiente fornisca energia al nostro sistema
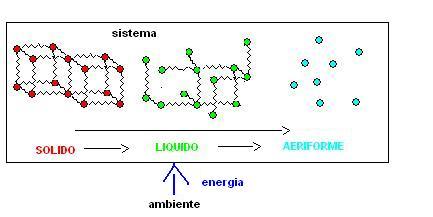
il diagramma sovrastante ci consente di capire ad esempio il motivo per il quale se noi mettiamo dell’alcool sulla pelle percepiamo del freddo (l’alcool evapora prendendo energia dal nostro corpo che si raffredda).
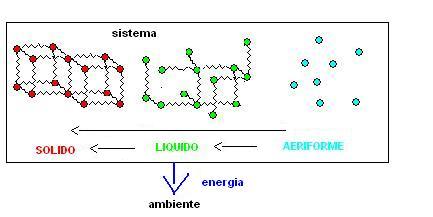
i passaggi di stato opposti ovviamente faranno si che sia il nostro sistema a fornire energia all’ambiente, questo spiega ad esempio perchè prima di nevicare la temperatura aumenti (del liquido si trasforma in solido e quindi energia viene ceduta all’ambiente).
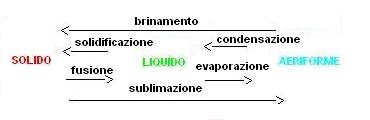
Ogni passaggio di stato ha un suo nome
Calore e Temperatura
Una forma in cui l’energia può essere trasferita dell’ambiente al sistema o viceversa è il CALORE.
Il calore è infatti una forma di energia (ENERGIA TERMICA), che può essere misurata in CALORIE.
Come CALORIA è la quantità di calore necessaria per innalzare di un grado centigrado (da 14,5 a 15,5 °C) un grammo di acqua alla pressione atmosferica.
Dato che il calore è una forma di energia, esso può essere calcolato anche nell’unità di misura del sistema internazionale ossia in Joule (J)
1 cal = 4,186 J.
Per ogni sostanza è possibile determinare la quantità di calore necessaria per innalzare di un grado centigrado un grammo di tale sostanza.
Questa proprietà intensiva del materiale si chiama calore specifico
Comunemente siamo propensi a considerare il calore e la temperatura come fossero la stessa cosa, ma è proprio vero?
In realtà tra calore e temperatura ci sono delle notevoli differenze.
Vediamo uno dei possibili modi in cui possiamo definire la temperatura.
Quando un corpo si muove nello spazio possiede una energia legata al suo movimento.
Questa forma di energia prende il nome di ENERGIA CINETICA.
Possiamo calcolare questa energia con la seguente formula
Energia cinetica = 1/2 M * V 2
Dove M= massa V = velocità.
Abbiamo visto come la materia sia costituita da particelle, queste particelle possono ovviamente muoversi e possedere quindi una certa energia cinetica.
Può sembrare strano, ma anche le particelle dei solidi in realtà si muovono.
Tanto per fare un esempio abbiamo visto come i legami interparticellari possano essere equiparati a delle molle, e come sappiamo le molle possono vibrare e quindi muoversi.
Possiamo definire la temperatura come un indice dell’energia cinetica delle particelle.
Temperature maggiori indicano che le particelle possiedono maggiore energia cinetica e che quindi si muovano con maggiore velocità.
Quando mescoliamo o mettiamo a contatto due corpi a temperature differenti dopo un certo periodo si raggiungerà un equilibrio termico.
Possiamo immaginare che le particelle del corpo più caldo (aventi energia cinetica maggiore) abbiano ceduto parte della loro energia a quella del corpo più freddo (le cui particelle avevano energia cinetica minore) ed all’equilibrio le particelle dei due corpi abbiano la stessa energia cinetica.
Il Calore è proprio l’energia scambiata in questo processo e ciò ci spiega il motivo per cui il calore si trasferisca sempre spontaneamente da un corpo più caldo ad un corpo più freddo.
Se continuiamo a raffreddare, continuiamo a diminuire l’energia cinetica e quindi il movimento delle particelle.
Giunti ad un certo punto dobbiamo pensare di arrivare a fermare le particelle e quindi di annullare la loro energia cinetica.
A questa condizione sarà associato un minimo assoluto di temperatura.
Questa temperatura equivale a -273,16 °C e viene denominata zero assoluto.
Possiamo costruire quindi una scala di temperature che parta dallo zero assoluto, questa scala prende il nome di scala di Kelvin.
Un grado Kelvin (°K) equivale ad un grado centigrado per cui
0 °K = -273,16 °C
273,16 °K = 0°C
373,16 °K = 100 °C
Poichè si tratta di una scala assoluta (parte da zero gradi) non esistono gradi Kelvin negativi.
Il calore e la temperatura nei passaggi di stato.
Supponiamo di voler cucinare della pasta e di mettere a bollire in una pentola dell’acqua.
Raggiunta l’ebollizione se proviamo a misurare la temperatura della massa d’acqua troveremo un valore (a seconda della pressione atmosferica e del fatto di aver salato o meno l’acqua) prossimo ai 100 °C.
A questo punto possiamo alzare la fiamma del gas ma osserveremo che la temperatura rimane costante.
Aumentando il flusso del gas, noi forniamo più energia (basta vedere la bolletta), ma dove va a finire questa energia se la temperatura non aumenta?.
Questa semplice esperienza ci fa comprendere come sia un grave errore confondere la temperatura con il calore, visto che non è sempre automatico che un incremento di calore fornito al sistema si risolva in un aumento della temperatura dello stesso.
Se consideriamo quanto detto fino ad ora la risposta a questa domanda dovrebbe risultare ovvia.
Riassumiamo le considerazioni fin qui fatte.
- La temperatura è un indice dell’energia cinetica delle particelle
- Le particelle nel liquido sono tenute insieme da interazioni che sono assenti nel vapore
Se la temperatura non aumenta, pur fornendo energia possiamo quindi (a seguito del punto (1) immaginare che il calore fornito non vada a provocare un incremento dell’energia cinetica delle particelle.
Risulta a questo punto plausibile che durante l’ebollizione il calore che noi forniamo serva per rompere le interazioni tra le particelle liquide trasformandole in vapore.
Fin tanto che nel nostro sistema in ebollizione coesistono le due fasi (liquido aeriforme) la temperatura rimarrà costante ed il calore scambiato in questa fase prenderà il nome di CALORE LATENTE.
CALORE LATENTE calore associato ai passaggi di stato che non determina variazioni di temperatura.
Il calore latente si distingue dal CALORE SENSIBILE, ossia il calore che determina variazioni di temperatura.
In altre parole se abbiamo un Kg di acqua a 20 °C e lo portiamo a 100°C dobbiamo fornire circa 80Kcal di calore sensibile.
A questo punto l’acqua inizia a bollire per cui l’ulteriore calore fornito non incrementa la temperatura (si tratta perciò di calore latente).
Il calore latente di evaporazione dell’acqua è di 539 cal/g
Possiamo quindi calcolare che per trasformare in vapore il Kg di acqua dovremo fornire 539 Kcal.
Riassumendo: 80Kcal per scaldare l’acqua ; 539 Kcal per farla evaporare completamente.
Una volta che l’acqua è diventata totalmente aeriforme il calore che forniremo diventerà nuovamente sensibile andando ad incrementare l’energia cinetica delle particelle di vapore.
Un fenomeno analogo lo possiamo osservare se raffreddiamo l’acqua.
Partiamo da 20 °C e raffreddiamo.
Da 20°C a 0°C abbiamo sottratto dal nostro Kg di acqua circa 20 Kcal.
A questo punto l’acqua inizia a congelare, la temperatura si ferma fintanto che non si sono formate tutte le interazioni necessarie per trasformare l’acqua liquida in ghiaccio.
Il calore latente di fusione(o solidificazione) dell’acqua è di circa 80 Kcal/Kg
Riassumendo: 20Kcal per raffreddare l’acqua ; 80 Kcal per farla congelare completamente.
Possiamo ora facilmente capire perché la neve ci mette tanto tempo a sciogliersi al sole, infatti per sciogliere un kg di neve ci vogliono le stesse calorie necessarie per portare da 20 a 100°C lo stesso quantitativo di acqua.
Le curve di raffreddamento e riscaldamento
Immaginiamo di riscaldare una sostanza pura, partendo dallo stato solido fino ad ottenerla completamente allo stato aeriforme e di costruire un grafico temperatura in funzione del tempo.
Quello che noi otterremo è una curva di riscaldamento simile alla seguente:
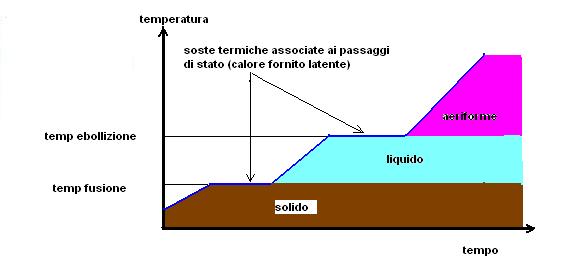
Partendo dalla sostanza solida potremo fornire del calore sensibile fino a raggiungere la temperatura di fusione.
In questa condizione, dove coesistono la fase solida e quella liquida la temperatura si arresta.
Dobbiamo fornire tutto il calore latente necessario per far passare l’intera massa solida completamente allo stato liquido, quindi la temperatura potrà riprendere la sua salita.
Arriveremo alla temperatura di ebollizione (coesistenza fase liquida e aeriforme) dove la temperatura si arresterà nuovamente fino alla completa evaporazione del liquido.
Una volta terminata la evaporazione la temperatura del vapore potrà continuare la sua salita.
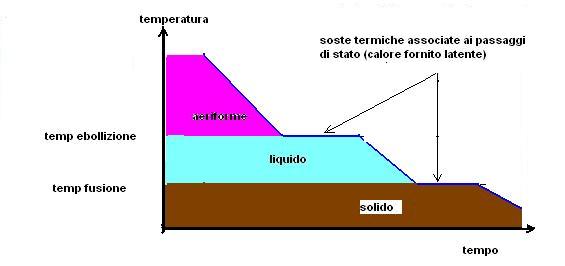
Se immaginassimo di raffreddare del vapore fino allo stato solido ovviamente troveremmo un diagramma opposto denominato curva di raffreddamento,
Trasformazioni chimiche e fisiche loro riconoscimento
Nell’unità didattica precedente abbiamo accennato alle trasformazioni chimiche parlando della caratterizzazione delle sostanze pure in elementi e composti.
Sia i passaggi di stato che le tecniche di separazione sono esempi classici di trasformazioni fisiche.
In queste trasformazioni il numero dei componenti del sistema e le loro caratteristiche chimiche non cambiano.
Possiamo avere acqua allo stato di vapore, liquida o ghiaccio ma pur sempre acqua rimane, oppure possiamo avere un miscuglio di tre composti ed ottenerli alla fine separati senza che sia avvenuta nessuna trasformazione di tipo chimico.
Cosa contraddistingue allora le trasformazioni chimiche da quelle fisiche?
Possiamo dire che mentre nelle trasformazioni fisiche vengono interessate solo le interazioni interparticellari ossia le interazioni tra particelle diverse, nelle trasformazioni chimiche vengono interessate le particelle intraparticellari ossia quelle interne ad una specifica particella.
Abbiamo visto ad esempio come nel passaggio solido liquido siano le interazioni interparticellare ad essere modificate e se ci pensiamo bene anche in una tecnica di separazione come la cromatografia noi sfruttiamo le diverse interazioni tra particelle di un miscuglio con quelle di un supporto fisso ed un supporto mobile.
Questo tipo di trasformazioni non modifica l’interno delle particelle e quindi non altera la loro natura chimica.
Molto spesso le trasformazioni fisiche sono reversibili, sono tali ad esempio i passaggi di stato ed anche se prendo due sostanze diverse le mescolo e le separo nuovamente riottengo le sostanze di partenza con le stesse proprietà fisiche caratteristiche.
Nelle trasformazioni chimiche viene, invece, alterata la struttura interna delle particelle.
Una sostanza generica A si può quindi trasformare in una sostanza completamente diversa (proprietà fisiche intensive differenti) B o addirittura in più sostanze chimiche diverse (ad esempio B + C).
Le reazioni chimiche possono essere quindi scritte con delle notazioni simili alla seguente
A -> B + C (A si trasforma in B + C)
I termini a sinistra della freccia si chiamano REAGENTI
I termini a destra della freccia si chiamano PRODOTTI.
Mentre le trasformazioni fisiche sono in genere reversibili e non provocano variazioni nei numeri dei componenti del sistema , quelle chimiche possono essere irreversibili e come nell’esempio soprascritto possono far variare (anche se non sempre) il numero dei componenti del sistema.
Come riconosciamo che è avvenuta una trasformazione chimica?
Quando pensiamo ad una reazione chimica siamo portati a idealizzarla come nei film di antichi alchimisti con sostanze che al semplice contatto provocano esplosioni o altri fenomeni particolari.
Nella realtà la maggior parte delle reazioni chimiche avviene senza che noi ce ne accorgiamo.
Le piante ad esempio a livello fogliare svolgono innumerevoli reazioni chimiche senza che noi ci accorgiamo di nulla o quasi.
In realtà l’unico modo corretto per valutare se è avvenuta una reazione chimica è quello di stabilire attraverso delle analisi delle proprietà chimiche fisiche se si sono formate sostanze diverse da quelle che avevamo in partenza.
Tuttavia ci sono dei “segnali” percepibili dai nostri sensi che ci fanno dire che con molta probabilità è avvenuta una reazione, vediamo quali sono:
- Sviluppo o assorbimento del calore, mescolo due sostanze e il sistema si riscalda o si raffredda.
- Comparsa o scomparsa di colori, mescolo due sostanze e si forma un colore
- Comparsa di odori particolari, mescolo due sostanze e si sviluppa un odore particolare
- Sviluppo di gas, mescolo due sostanze e si formano delle bollicine di gas
- Formazione di una sostanza insolubile, mescolo due sostanze e si forma una sostanza insolubile
Queste osservazioni vanno fatte però con molta attenzione per prima cosa bisogna infatti accertarsi delle caratteristiche dei reagenti separati.
Se io ad esempio ho un reagente che odora di aglio ed alla fine trovo un odore di aglio non è assolutamente detto che si sia formata una nuova sostanza odorosa.
Altro esempio, se io mescolo una sostanza gialla con una blu ottengo una sostanza verde, ma detto colore non è legato ad una nuova sostanza formatasi ma dalla mescolanza dei colori primari.
D’altro canto abbiamo visto come l’evaporazione dell’alcool dalla pelle provochi un raffreddamento che non è legato ad una trasformazione chimica.
Va infine ricordato che alcune sostanze cambiando di stato fisico cambiano di colore, ad esempio lo iodio solido e grigio quando diventa gassoso è viola.
Se a tutto ciò aggiungiamo che la maggior parte delle reazioni avviene senza manifestazioni esteriori percepibili dai nostri sensi comprendiamo come sia più difficile del previsto valutare quando e se è avvenuta una trasformazione chimica.